这个需要看你的参数变更,是否能够纳入方法变更的范畴了,例如根据《中国药典分析检测技术指南》规定的高效液相色谱法里面归纳总结了各国药典容许的参数变动,在此范畴内的,均不算方法变更。
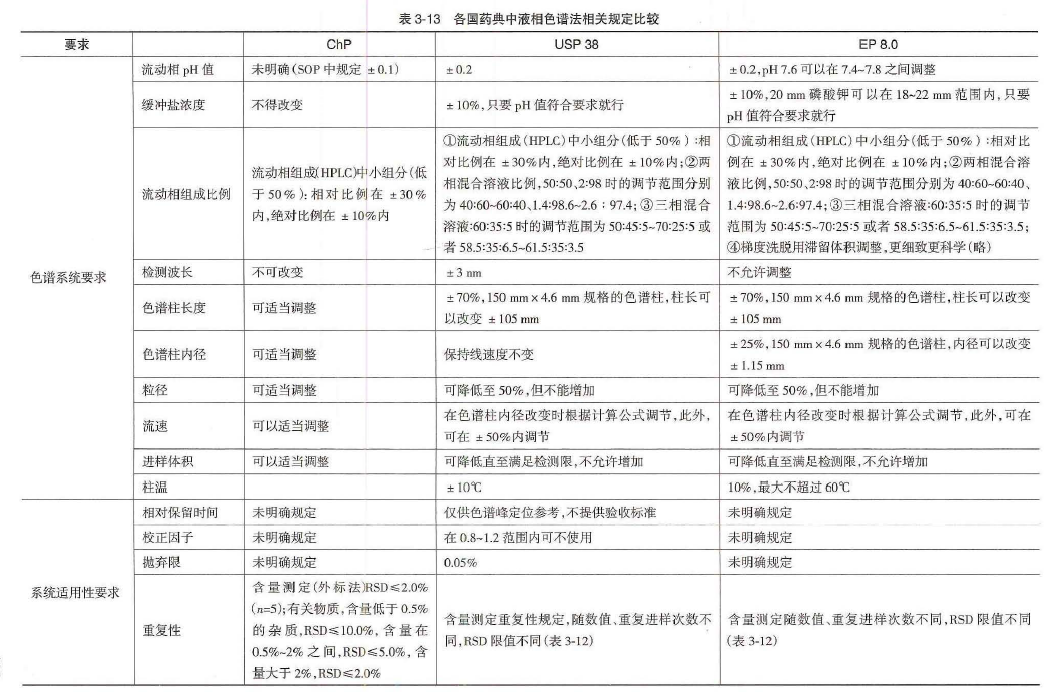
如果你确实涉及到方法变更的话,按照《已上市化学药品药学变更研究技术指导原则(试行)》的规定,属于注册标准变更的检测方法变更范畴,具体实施要求如下:
(二)重大变更
1、变更情况
此类变更包括但不限于以下情形:
(1)变更检验方法。
(2)放宽控制限度。
(3)删除注册标准中的任何项目。
2、研究验证工作
(1)说明具体变更情况和原因,提供变更后的质量标准。
(2)对质量标准变更合理性进行研究。
如涉及检验方法改变,需对新方法进行方法学研究验证并应与变更前方法进行比较,确保方法变更不引起药品质量控制水平的降低。另外,需对一定批次样品(建议含近效期样品)批分析结果进行汇总,以考察在原定的有效期内,药品是否符合修订后质量标准的要求。
如涉及删除标准中任何内容,需结合药品生产过程控制、药品研发过程及药品性质等综合分析和证明该项变更不会引起药品质量控制水平的降低。
如涉及放宽控制限度,需进行详实的研究,必要时需要有关安全性和/或有效性试验资料或文献资料的支持。限度变更还需基于一定批次样品的检测数据并符合相关的技术指导原则。
(3)按变更后的质量标准对三批样品进行检验,应符合规定。
1、各国药典的参数变更范围,来源于《中国药典分析检测技术指南》摘录的各国药典通则部分的内容,不过我没有逐个核实。

2、根据上面两位老师答复内容,我重新学习了一下变更指导原则,确实注册标准只是指的原料药和制剂成品,将辅料标准变更归属到重大变更确实不妥。
普通口服固体制剂,涉及分析方法表更的描述有以下几个情况
· 变更辅料的供应商,但是辅料的技术等级不变,辅料的质量不降低。——属于微小变更
· 提高辅料的质量标准(如收紧质控限度)或者因药典版本的更新或增补而引起的质量标准的变更。——属于微小变更
· 变更辅料的技术等级,如用微晶纤维素PH200替代微晶纤维素PH101)。辅料的技术等级主要与辅料的质量标准、用途、杂质状况等相关。——属于中等变更
· 变更辅料的质量标准(微小变更(2)除外),质量控制水平不降低。——属于中等变更
所以,如果您这边方法参数的变更范畴达到质量标准变更的范畴的话,如果是因为变更辅料供应商的原因,可以归属为微小变更;如果并非变更供应商的原因,而是自己重新开发方法,似乎应该归属为中等变更。不过我们确实没有相关实践经验,很少会在获批后辅料厂家不变的情况下调整分析方法,不知题主是否可以提供更多信息,比如方法变更原因,变更的范围。
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:


