我认为对于微生物限度的结果如何报告需要针对不同的类型来分析;
首先您提到的对于工艺用水的报告结果时可以输出XXcfu/ml,药典里面也是这样规定的,我对于这个的理解是在于:对于生产出或待检验的产品本身是否均一(如:工艺用气、工艺用水、产品制作的供试品溶液),其本身的样品每一份都是具备代表性或者溶解后的样品是均匀分散的,这种可以考虑按照XX/ml/g来进行判断;但是也需要考虑如果是风险比较大的产品或者物料需要考虑足够的样本量来证明质量水平,如注射用水CP中至少需要考虑100ml检测,报告值为10cfu/100ml;
其次对于不均一的一些产品,其报告格式能否定义到cm²,首先需要关注行业标准/国标里面是否对其进行规定,如药用低密度聚乙烯袋直接规定为XXcfu/100cm²,胶塞(不知道多大的)如果使用的是擦拭法我觉得可以考虑药用低密度聚乙烯袋的标准。
如果行业内没有规定,或者行业内无可用参考,我认为可以从下面来进行判断:选择的方法是什么?如果是擦拭法建议足够样本量检测,报告尽可能大的结果;如果是足够样本量浸泡后过滤法(浸泡提取后相对均匀)我觉得可以考虑换算。
下面是药用低密度聚乙烯袋微生物限度行业标准示例: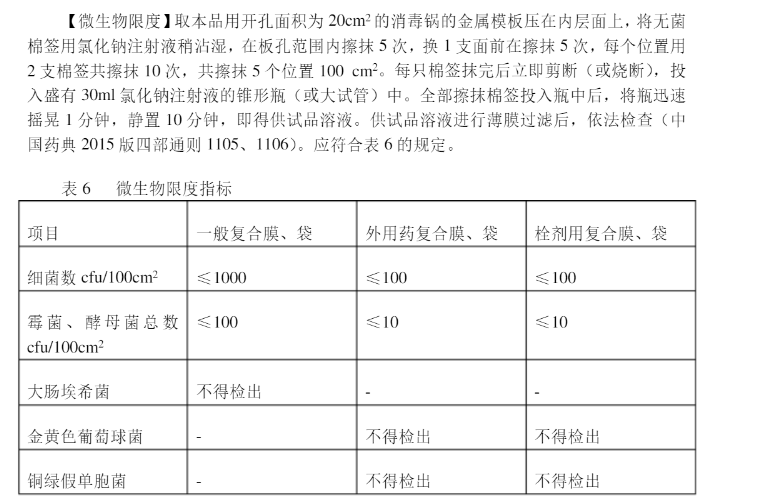
微生物限度报告的需求或标准,不仅仅是QC输出的一个平皿的结果。这部分的工作是需要判断此工序的微生物负载是否符合工艺的要求。题主提到的工艺用水有药典的要求,但是检验方法上可能不一样,也就是不同的稀释梯度。
对于胶塞,通常是取样几个胶塞,通过缓冲液将表面的微生物洗脱下来再进行计数。测试过程中有缓冲液用量(稀释倍数)-过滤(稀释倍数)-计数结果等步骤。当QC汇报结果时只能将最终的计数反算成相应的原始的进行汇报。当然,这阶段需要从工艺上设定接受标准,比如,xx CFU/胶塞,这些与工艺控制要求相关。
其他例子可以参考中国药典四部1105的一个截图,如下:结果能与工艺判断相关联才是有用的结果。如果只是CFU/皿,那又有何意义?

这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
