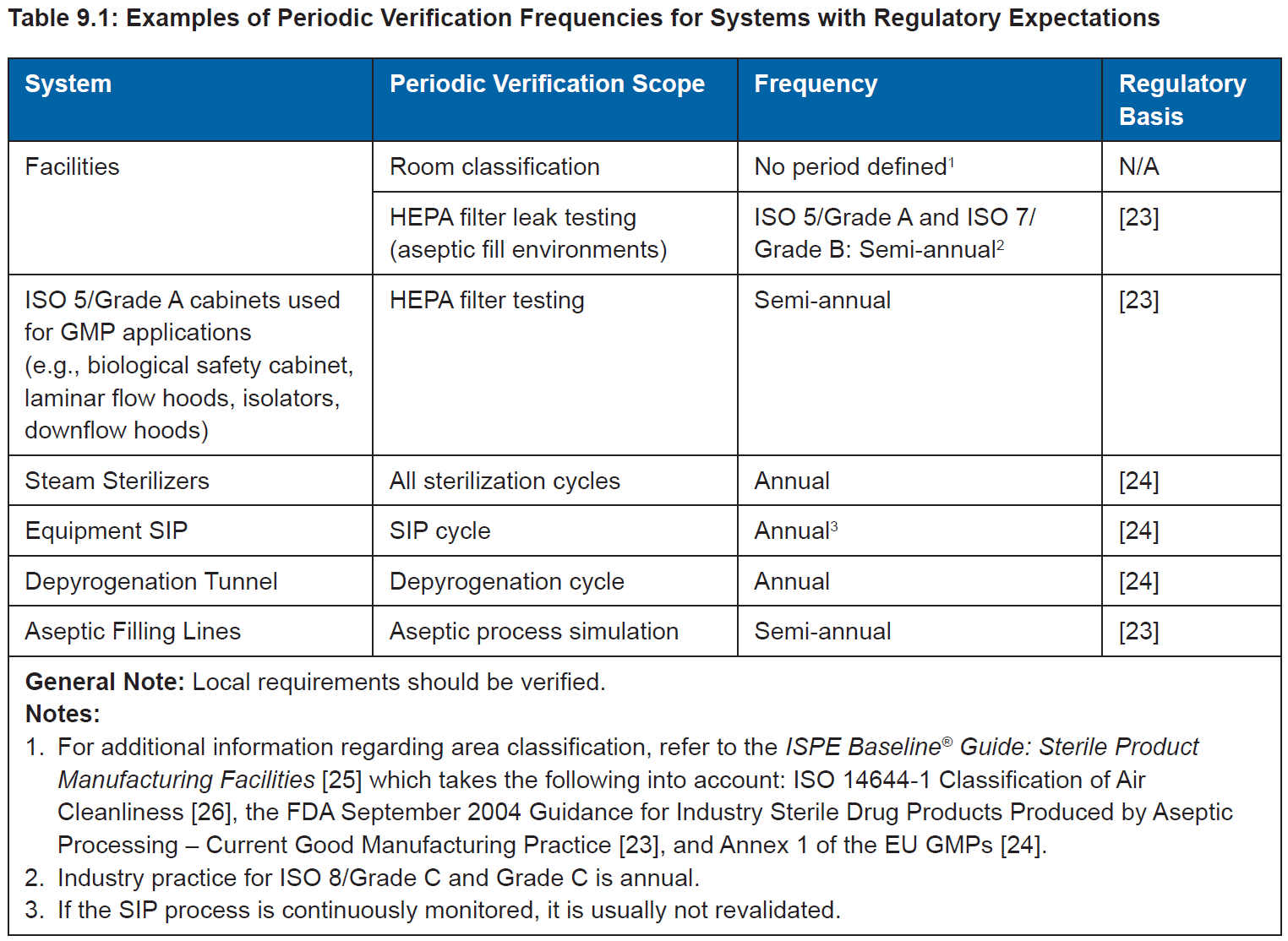
2010版GMP 附录11 确认与验证
第五十二条 应当采用质量风险管理方法评估变更对产品质量、质量管理体系、文件、验证、法规符合性、校准、维护和其他系统的潜在影响,必要时,进行再确认或再验证。
第五十三条 当验证状态未发生重大变化,可采用对设施、设备和工艺等的回顾审核,来满足再确认或再验证的要求。当趋势出现渐进性变化时,应当进行评估并采取相应的措施。
2023版GMP指南 口服固体制剂 章节7.3 C 再确认与定期审核


ISPE调试与确认指南第二版 第9章 Periodic Review
周期性评估需要回顾4个质量系统:GMP compliance expectation, change control system, maintenance/calibration system, deviation system
审核流程如下:
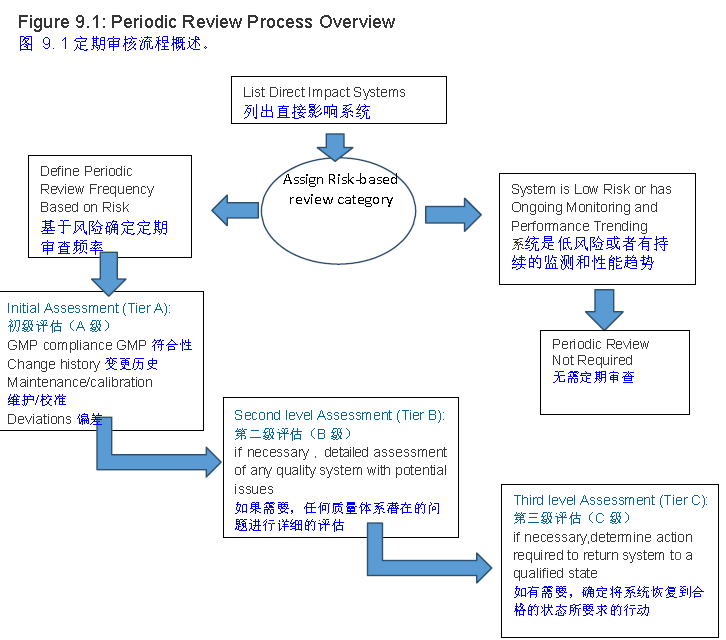
综上,从法规指南角度,支持以持续评估的方式进行再确认,评估的内容见上面要求。
是否进行再确认评估方面:从变更、位移、产品质量回顾、异常趋势、偏差、设备运行和维保记录、校准历史、GMP法规或指南更新要求、SOP的变化和修订情况、最近的确认文件等方面,对设备进行周期性审核,并根据审核结果确定系统是否处于确认状态。如果周期性评估结果显示,系统有必要进行再确认,则根据评估结果给出相应的建议。
应结合公司的验证策略,如采用ISPE第二版中的策略,那么是可以一直持续这种方式评估,但是对于目前国内老师检查的情况来看,如采用持续评估的方式,那么意味着要收集很多的信息及总结评估,目前这种持续评估的方式更多可能适合于自动化程度高的设备或风险较低的设备。
- 基于风险的再验证周期确定有两种方式:
- 第一种:在PDA TR 54-5 中,对再确认周期评估,将通过对所有的直接影响系统评估系统的复杂性、稳定性、关键性来确定,具体评估如下
-
- 界定系统复杂性:界定系统功能性、控制软件和硬件的复杂程度以及其他因素。
- 微小复杂系统。公司对技术和实际功能有充分认识,有相关的实际系统控制经验;微小复杂系统可能包括明确的商业化低风险系统,该系统被广泛地应用在商业化生产中。·
- 中等复杂系统。公司有高水平的经验和认可度,或系统有(极少的)硬件或软件界面设计,代表了相对标准的技术。
- 复杂系统。公司采用新的技术或对新技术只有有限的认识和经验,复杂系统可能包含多个硬件/软件界面设计。如自动的生物反应器控制系统。
-
- 识别系统稳定性
-
- 稳定系统:包括那些能够适应一个较宽泛的变化的系统,同时保留预定输出且对相关的输入变量不敏感。
- 中等稳定系统:对输入变量中等敏感,需要一定的控制。
- 有限稳定系统:对输入变量非常敏感,因此必须在严格的控制环境下使用。
-
- 确定系统的关键性
-
- 关键性高:直接影响CQA,将直接影响患者生命安全和功效,与无菌控制或者产品生物污染相关或为GMP关键系统,或关键工艺系统。
- ·关键性低:不直接影响 CQA和CPP,如辅助系统、非关键工艺、间接影响系统、无影响系统等。
- 第二种:在ISPEC&Q(第二版)中,对再确认周期评估也有相应的介绍,总结如下该指南中提出需要进行两个阶段的工作:
- 一是系统分类和计划安排;
- 二是周期性审核执行。
- 在系统分类评估中,系统根据影响产品质量的潜力进行分类。通常,由于过程中测试用于早期制造的系统被认为比用于更接近成品的阶段的系统具有更低的风险。该类别定义了周期性审核频率计划。考虑到系统影响产品质量的可能性,这些频率应基于SME的决定必须管理当地相关法规和/或监管指南中定义要求的系统以满足这些要求。该指南并作出周期性审核频率进行了举例。将类别分成四级:0级,该类别依赖于现有的质量体系和性能监测计划,不需要定期检查,例如关键的公用设施,例如压缩空气、PW或WFI;1级,该类别已经从系统特定的法规中确定了要求,并且不受额外的定期评估活动的限制,例如蒸汽灭菌柜和隧道烘箱;2级,每两年进行一次评审;3级,每隔三年进行一次评审。当然,也有很多其他的方式,基于简单的风险评估方式进行不同系统的再验证周期的制定。比如,将系统分成两种等级,关键工艺设备、公用设施评估为一年;其他辅助系统评估为两年。还有一些企业,根据生产线的产品的特性、对患者的影响性、对周期进行划分,将无菌生产线的关键工艺设备、所有公用设施评估为一年的周期;口服固体制剂生产线所有工艺设备、以及无菌生产线辅助设备和系统评估为两年的周期。无论采用哪种方式,都要和风险评估和科学制定相应的周期。
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因: