2个回答
CHINA GMP 2010
第一百五十条 文件是质量保证系统的基本要素。企业必须有内容正
确的书面质量标准、生产处方和工艺规程、操作规程以及记录等文件。
第一 百五十一条 企业应当建立文件管理的操作规程,系统地设计、
制定、审核、批准和发放文件。与本规范有关的文件应当经质量管理部门
的审核。
第一百五十二条 文件的内容应当与药品生产许可、药品注册等相关
要求一致,并有助于追溯每批产品的历史情况
质量方针、质量目标;
●场地管理文件;
●组织机构和岗位说明书;
●管理规程和操作规程;
●质量标准(含检验规程);
●生产工艺规程;
参考中国GMP Guideline 2023 质量标准、工艺规程、操作规程、稳定性考察、确认、验证、 变更等其他重要文件记录,空白记录(批生产/包装记录,批检验记录,其他公用、辅助记录等
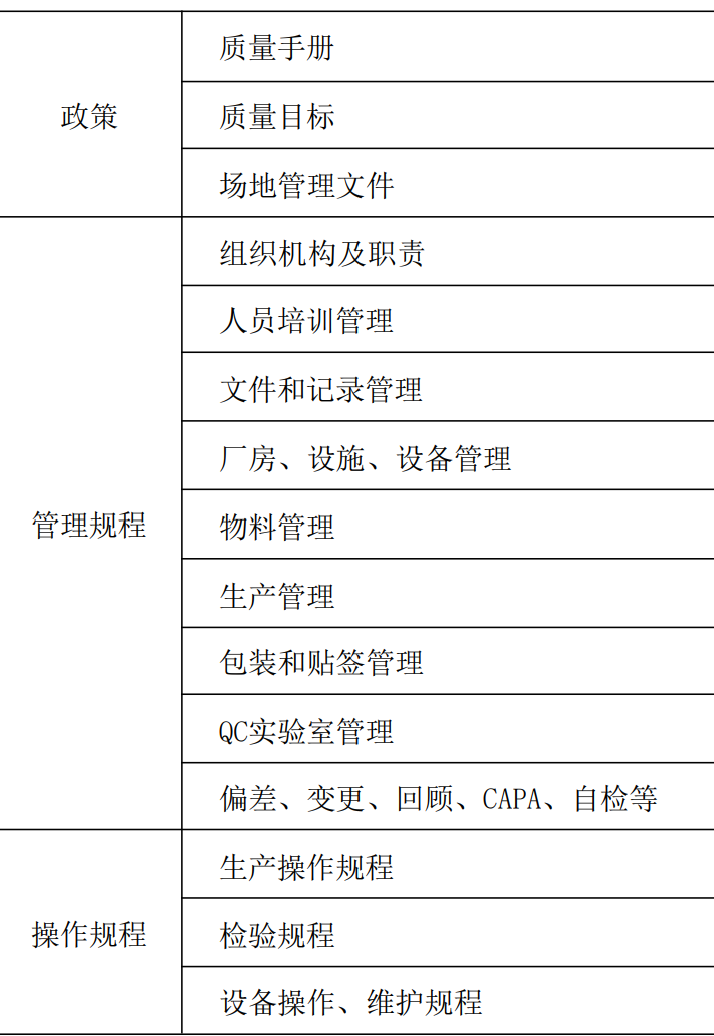
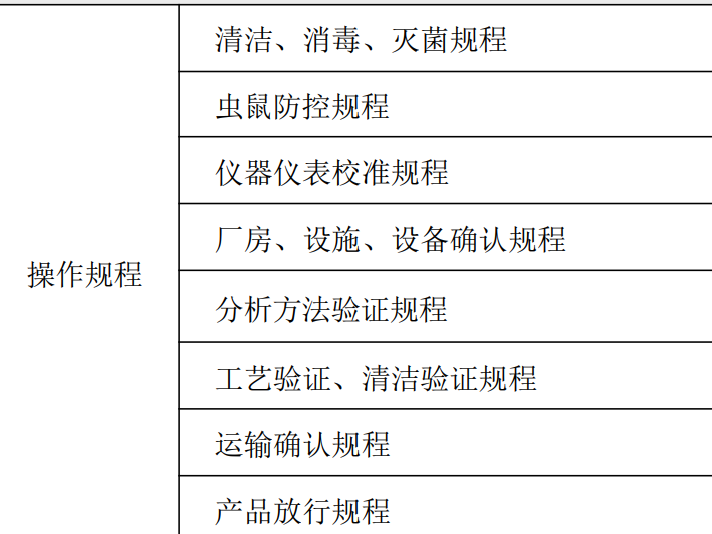
在GMP(2010年修订)中:【第一百五十条 文件是质量保证系统的基本要素。企业必须有内容正确的书面质量标准、生产处方和工艺规程、操作规程以及记录等文件。】
另参考第一版中国GMP指南,原料药,6 文件与记录:【就文件系统而言,制剂和原料药生产的文件要求,基本上是一致的,这部分内容在“质量体系”的第6章质量管理系统文件中有详细的描述,此处不再赘述。本章仅就具有原料药特点的下列文件进行讨论,包括:6.1 质量标准;6.2 设备使用日志;6.3 原料、中间体、原料药的标签和包装材料的记录;6.4 生产工艺规程;6.5 批生产记录及批包装记录;6.6 实验室控制记录;6.7 批生产记录审核】
——供参考。
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
这{{threadTextType}}正{{isAdminText}}
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
