4个回答
由于提问可能隐藏了一些信息,考虑可能的实际场景:
1. 西林瓶中的疫苗组分始终是要用注射器抽取出来的(之前应该也是这么操作的,但是由医护人员采用商品化的注射器,在包装盒里增加只是为了方便);
2. 猜测增加药液转移器有可能是涉及到两种疫苗组分(抗原和佐剂)的用前混合,还有可能涉及混合后的疫苗为多人份的问题;(如果变更前不涉及,可能需要补充相应的研究)。
如果变更前也涉及上面的环节,那么应该已经有了相关的研究(临床用药稳定性、相容性等),那么可以按《已上市生物制品药学变更研究技术指导原则(试行)》下面的说明尝试一下的:
当然,如果有直接的监管沟通途径,最好再确认一下。

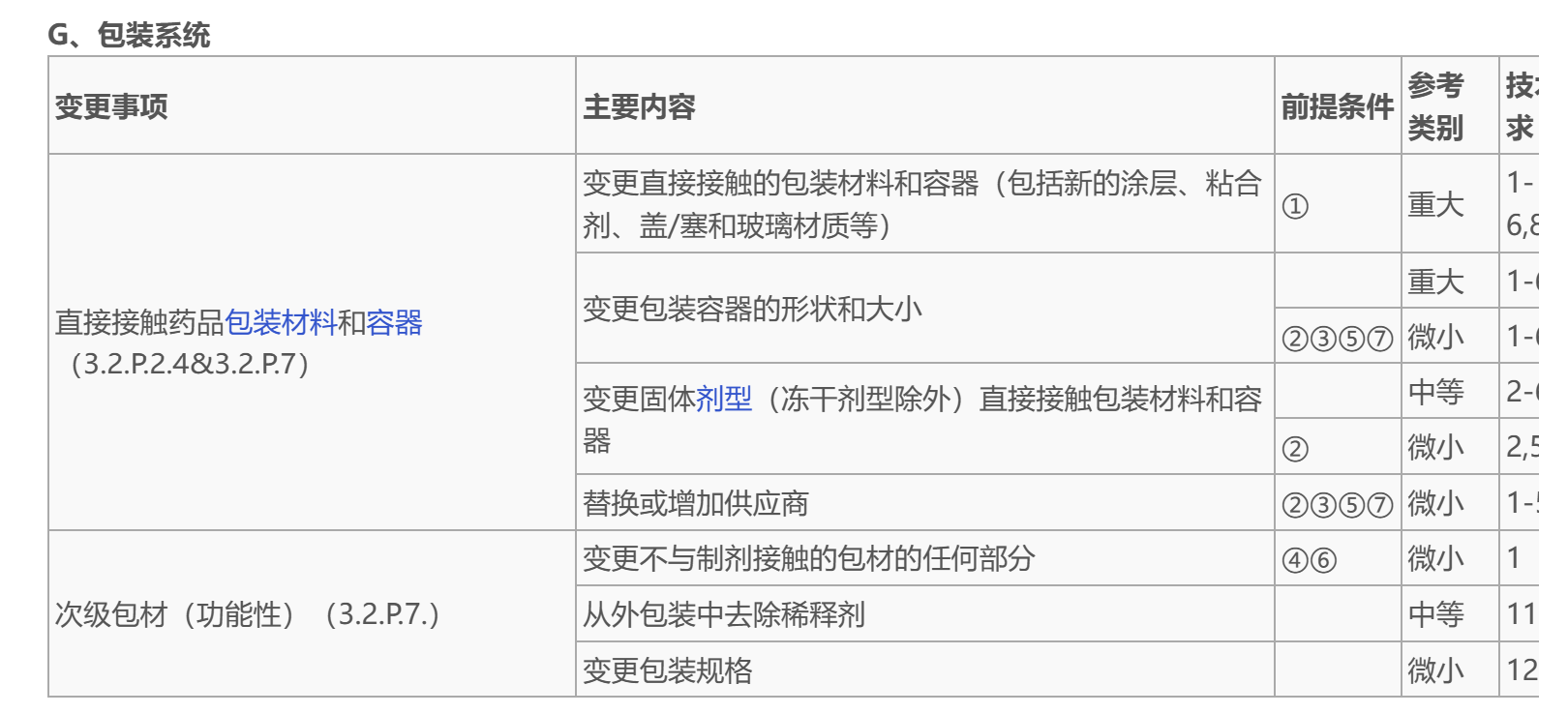
我在想,这个问题是为了方便疫苗的使用,在西林瓶包装不变的基础上,为了方便用药,增加药业转移器和注射器到疫苗的包装盒里面。如题,这两个器械都是注册了的,也就不属于器械注册答案的范畴。同时,变更新包装形式和给药装置的“主要内容”是“注射剂变更规格”变更事项下的内容,也就是说规格变化,参照此项下的其他两项,浓度和体积变更,那包装形式应该是题中“西林瓶包装”的范围,个人理解是也不属于此项的内容。个人理解是更换了次级包材,可参见《已上市生物制品药学变更研究技术指导原则(试行)》的内容。次级包材在下图也有示例(主要内容),变更应该是改变了小盒的大小(增加了两个器械)和需要修订说明书(可能需要指导两个器械的使用),以上,希望有帮助。
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
这{{threadTextType}}正{{isAdminText}}
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:

