问题1: 加速6个月不需要按照0个月放行标准全检,依据一:ICH Q1A(R2) "稳定性研究应检验那些在贮藏期间易变化的、可能影响其质量、安全性和/或有效性的 项目。检验项目应包括物理、化学、生物和微生物特性。"http://lib.shilinx.com/wiki/index.php?title=ICH_Q1A%28R2%29_Stability_Testing_of_New_Drug_Substances_and_Products&searchText=Q1A
依据二:《中国药典》9001 原料药物与制剂稳定性试验指导原则,“应包括所有的稳定性重点考察项目”,详见http://lib.shilinx.com/wiki/index.php?title=%E4%B8%AD%E5%9B%BD%E8%8D%AF%E5%85%B82020_%E5%9B%9B%E9%83%A8_9001_%E5%8E%9F%E6%96%99%E8%8D%AF%E7%89%A9%E4%B8%8E%E5%88%B6%E5%89%82%E7%A8%B3%E5%AE%9A%E6%80%A7%E8%AF%95%E9%AA%8C%E6%8C%87%E5%AF%BC%E5%8E%9F%E5%88%99&searchText=%E5%8E%9F%E6%96%99%E8%8D%AF%E7%89%A9%E4%B8%8E%E5%88%B6%E5%89%82%E7%A8%B3%E5%AE%9A%E6%80%A7%E8%AF%95%E9%AA%8C%E6%8C%87%E5%AF%BC%E5%8E%9F%E5%88%99
问题2: 常温(1-30℃)储存,稳定性长期放在25℃应该不被接受。稳定性研究应至少包括实际储存的最苛刻条件,如果储存温度到30℃,长期稳定性至少要做到30℃。
针对第二个问题,我从另外一个角度回答下。
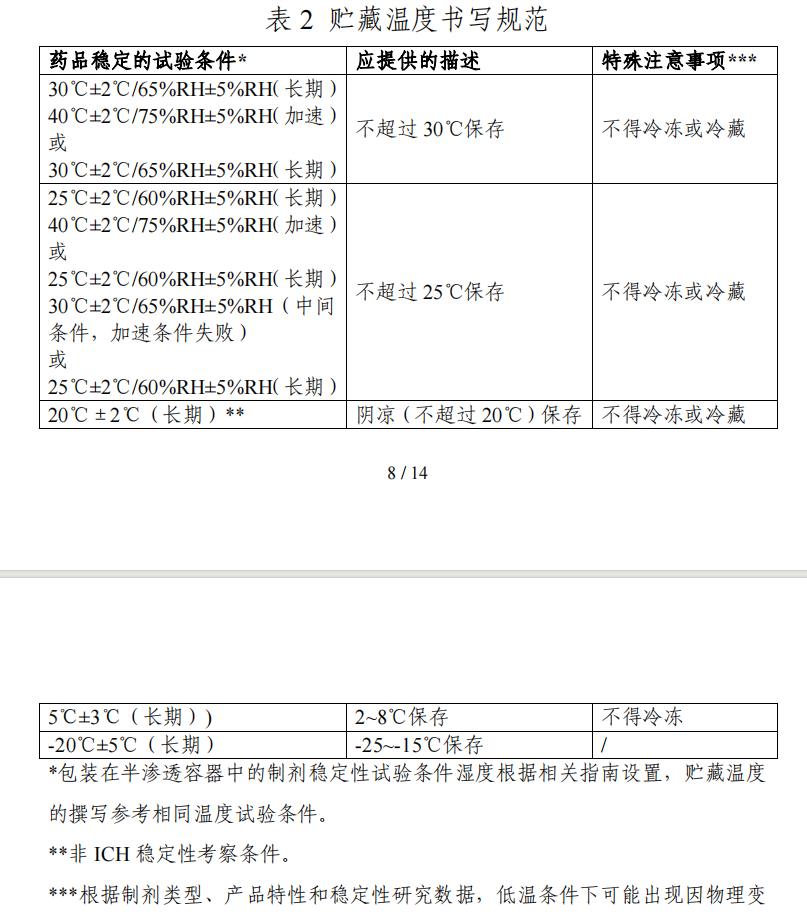
https://www.cde.org.cn/main/news/viewInfoCommon/defca6a1f3ba33d0bad6f309e5a0b816 《化学药品说明书及标签药学相关信息撰写指导原则(试行)》的通告(2023年第20号)这里可以看出,长期条件为30℃,贮藏条件才能标示为:不超过30℃保存。如果为了常温储存,那么建议长期条件为30℃。
1、加速试验末点不一定需要按照0个月标准全检,但重点观察项目要检测(至少包含CQA),一般来说末点加速建议全检。因为一般加速6个月是加速末期,主要看非常规条件下药品的稳定性,为药品超出储存条件偏差、延长效期等提供依据。而且如果25℃±2℃/60%RH±5%RH条件下进行长期试验,当加速6个月发生变化以应进行中间条件试验。
1.1 依据有1.1 9001 原料药物与制剂稳定性试验指导原则 药典会描述"其目的是通过加速药物的化学或物理变化,探讨药物的稳定性,为制剂设计、包装、运输、贮存提供必要的资料。供试品在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月。所用设备应能控制温度±2℃、相对湿度±5%,并能对真实温度与湿度进行监测。在至少包括初始和末次等的3个时间点(如0、3、6月)取样,按稳定性重点考察项目检测。如在25℃±2℃、相对湿度60%±5%条件下进行长期试验,当加速试验6个月中任何时间点的质量发生了显著变化,则应进行中间条件试验。中间条件为30℃±2℃、相对湿度65%±5%,建议的考察时间为12个月,应包括所有的稳定性重点考察项目,检测至少包括初始和末次等的4个时间点(如0、6、9、12月)。"。
1.2 化学药物(原料药和制剂)稳定性研究技术指导原则 CDE | 2015-02-05“加速试验通常采用3个批次的样品进行,放置在商业化生产产品相同或相似的包装容器中,试验条件为40℃±2℃/75%RH±5%RH,考察时间为6个月,检测至少包括初始和末次的3个时间点(如0、3、6月)。根据研发经验,预计加速试验结果可能会接近显著变化的限度,则应在试验设计中考虑增加检测时间点,如1.5月,或1、2月。”
1.3 ICHQ1里面也有相关的要求,Q1A(R2) Stability Testing of New Drug Substances and Products Q1A(R2) 新原料药和制剂的稳定性试验 ICH | 2003-02
2、我所经历的,曾经有老师提出过这个问题,。而且我们的药品在中国申报的(南方与北方的气温差异)。
主要还是看你们的药品要销售所在地,如果销售往赤道以北的地方,可能不会被挑战。如果以南,必然被挑战。建议做个中间条件试验。如长期试验的放置条件为30℃±2℃/65%RH±5%RH,则无需进行中间条件试验。
下表为国际气候带,供参考:

这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
