一、法规依据:
1、中国药典“9 1 0 0 分析方法转移指导原则”分析方法转移( analytical method transfer) ,是一个文件记录和实验确认的过程,目的是证明一个实验室(方法接收实验室)在采用另一实验室(方法建立实验室)建立并经过验证的非法定分析方法检测样品时,该实验室有能力成功地操作该方法,检测结果与方法建立实验室检测结果一致。分析方法转移是保证不同实验室之间获得一致、可靠和准确检测结果的一个重要环节,同时也是对实验室检测能力的一个重要评估。本指导原则总结了可能存在的分析方法转移的类型和转移方案的内容等。本指导原则不提供统计方法相关信息,也不包含微生物和生物检验方法的转移。
其中“对比试验”:比对试验是分析方法转移时最常用的方法,需要接收方和转移方共同对预先确定数量的同一批次样品进行分析。也可以采用其他方法,如:在样品中加人某个杂质的回收率实验,接收方能够达到预先制定的可接受标准。分析时要依据已被批准的转移方案,此方案包括明确列出的细节、使用的样品、预先制定的验收标准和可允许的偏差。检测结果符合预先制订的可接受标准是确保接收方有资格运行该方法的必要条件。
2、GMP指南“质量控制”里面:
10.3.1 方法转移方案
为保证方法转移的顺利实施,在双方充分沟通的基础上,确定方法转移方案。方法转移方案应对以下内容作出明确规定(参见实例3),并经双方审核、批准。
- 方法转移的目的;
- 待转移的检验方法;
- 物料:试验样品(包括:批号、剂量、产品号、储存条件)和标准品(批号、储存条件、含量及有效期等);
- 试验样品应为同批有代表性的样品,标准品最好为同来源同批次。样品和标准品在运输过程中要符合其规定的储存条件;
- 接受标准;
- 异常数据的调查;
- 实验结果的评估;
- 双方的职责。
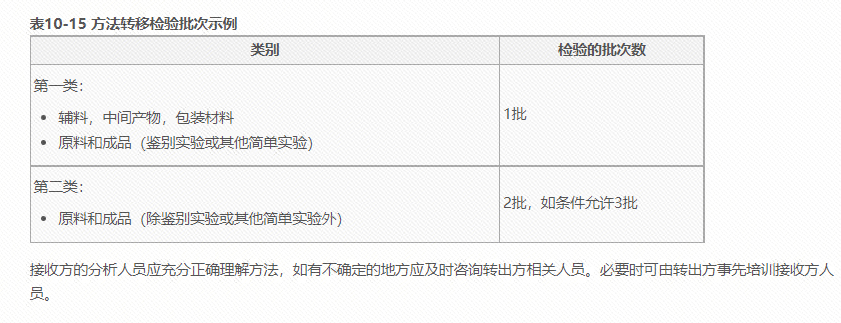
3、WHO技术转移指南里面也有相关的说明:
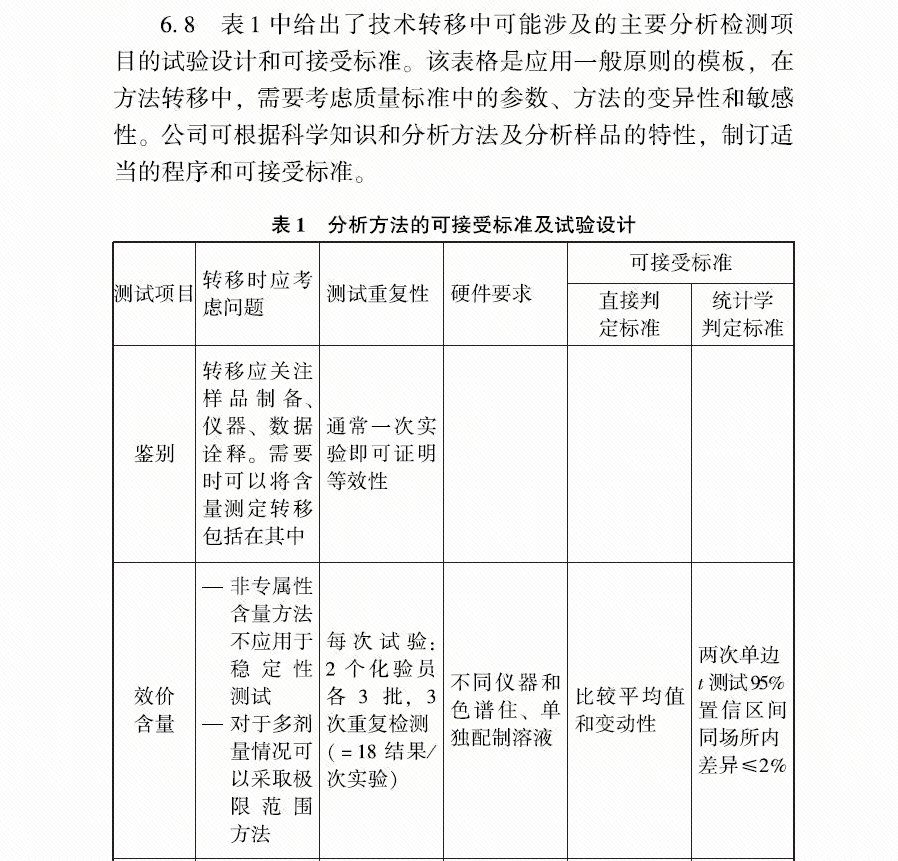

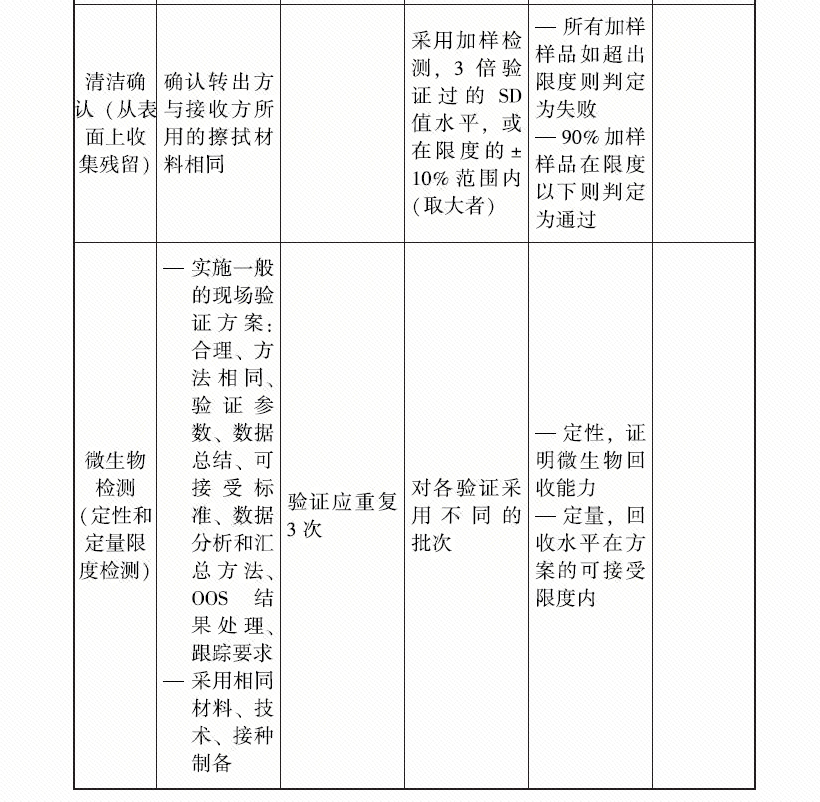
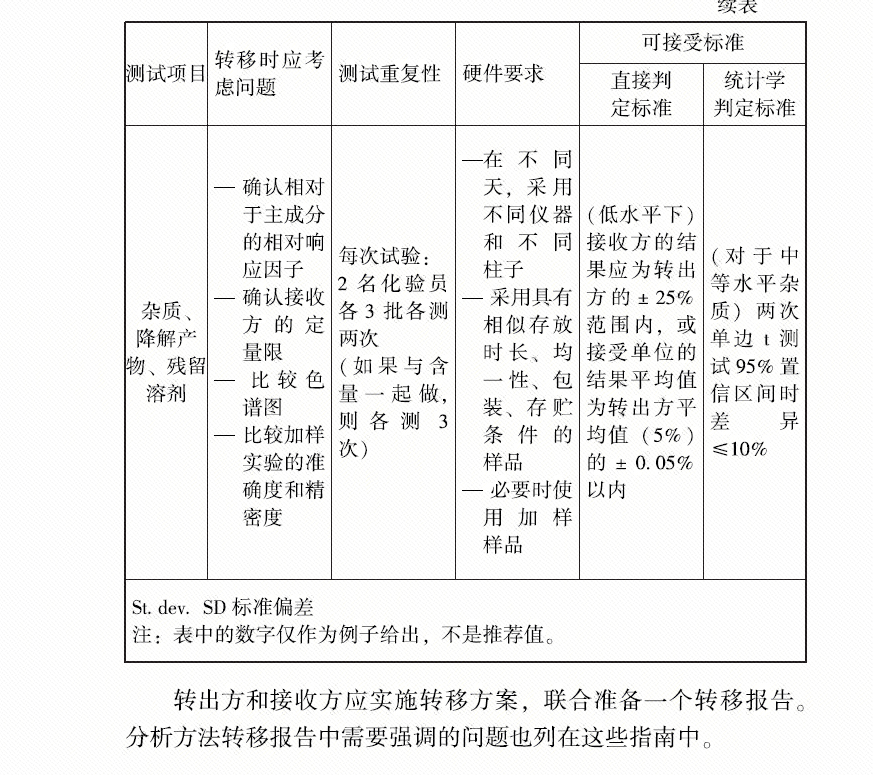
4、FDA关于生物药品的方法转移的有个指南,里面关于批次选择的描述为:

5、MHRA有个关于方法转移指南里面的:
Analytical method transfer is a verification process which has much in common with the validation activities described in EU GMP Annex 15 and the guidance it contains provides a useful framework to work from.
6、中检院文献检索:


二、思考:
首先不管是CHP还是USP里面的都是针对化药的,但是考虑到你这个转移只针对生物制品一个反相的纯度,所以我认为可以参考化药的方法转移,那些限度同同样适用于此。
另外,不管是CHP,GMP指南还是FDA生物药品方法转移里面的都是强调是根据转移的“具体检测项目”,不同的风险,不同的做法。所以最终还是要根据你转移的具体的检测项目,人员熟练度,方法成熟度等情况而定。并没有一个固定的一定要选几批,分别做几次,RSD或相对平均偏差要求是多少的硬性规定。
三、建议:
由于题目没有说的太清楚,那么猜测以下,在第三方委托检测机构方法应该是经过验证的,而受托生产商应该是一个CDMO企业,接触的项目较多。所以从这方面考虑人员熟练度应该还好。此外,你们处于临床阶段,批次较少,选择一批次可以理解,但是只做一次我认为不可接受,至少,至少也要分别做两次。至于接受标准,这里可以参考上述提供的一些标准比如相对平均偏差≤2.0%。当然,这个限度可以稍微再放宽点,还是要根据你们历史检测批次自己本身的一个偏离程度来考虑。
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
