1个回答
如果中等变更,问题不大,如果重大变更,则需要根据品种情况进行安全性、有效性评估。变更具有关联性,工艺的变更一般涉及面较广,大概率是重大变更。国内没有参比,建议尝试申请自己作为参比,然后和自己变更前的比较。
国家药监局一直以来对药品上市后变更严格监管 , 严厉打击药品上市后非法变更,在再注册工作中也明确了涉及工艺变更的工作要求。2010年8月13日《关于药品再注册审查有关问题处理意见的函》(食药监注函〔2010〕168号)规定“对再注册申报工艺与原批准工艺相比发生变更的 , 若工艺变更不影响药品质量 , 请生产企业报省级药品监管部门备案后,再予再注册;若工艺变更可能影响药品质量 , 请药品生产企业按照《药品注册管理办法》的相关规定报补充申请,待批准后再予再注册。”
截至2021年1月5日 , 国家药监局官方网站数据库中有效的国产药品共156816个,进口药品共3826个 , 大部分为获批5年以上并通过再注册的药品。按照前述药品再注册的要求,通过再注册的药品,其申报工艺合法性已经经省级监管部门审查。对新修订《药品管理法》和《药品注册管理办法》实施前,持有人或生产企业按照法定程序申报的工艺变更,不需按照新的变更管理规定及技术要求重新申报,不因新的变更管理规定及技术要求的变化视为非法。
变更控制程序图:
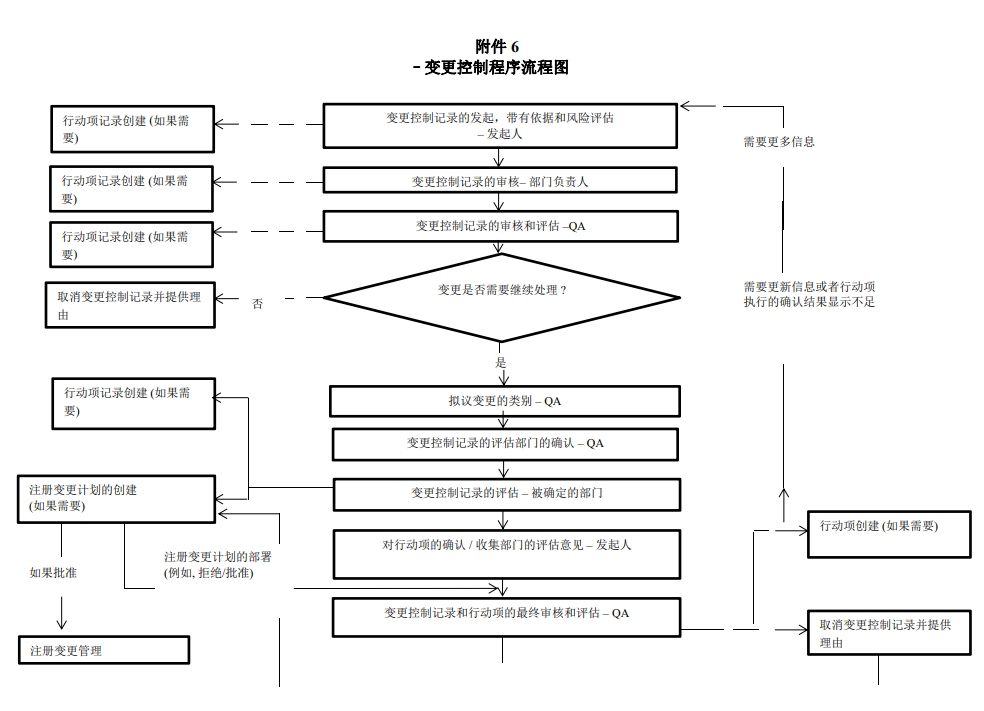
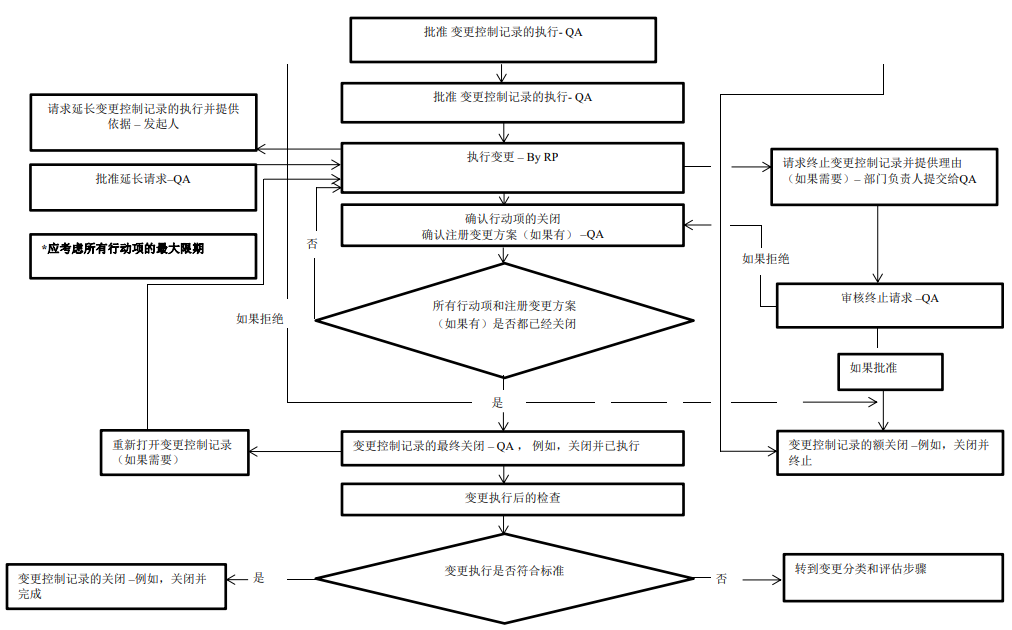
关于各类变更,请点击下方链接查看详情:
1、微小变更
2、中度变更
3、重大变更
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
这{{threadTextType}}正{{isAdminText}}
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
