回答:
对于设备类的确认:在GMP《确认与验证》附录中,第14条,安装确认至少应包含的内容中描述:(三) 相应的仪器仪表应进行必要的校准。
这里的必要的校准,主要是指设备、一期上面的不能拆卸的一些仪表,一般在安装确认阶段会把所有的仪表都校准一遍,运行的时候只需要检查就行,如果安装确认阶段检查仪表已经经过校准,则可不进行校准。所以在安装确认的时候,应进行一些仪表的校准。
对于实验室的仪器,仪器上的一些仪表,如压力表、温度表、转速表等这些表类的,在安装时应检查仪表有没有校准,所以在安装确认阶段,对仪表应检查是否经过校准,运行前应该检查,性能前还应该检查。
所以仪器的验证顺序是:
安装确认(IQ)检查仪表有无校准,没有校准应在该阶段把能校准的完成校准。
运行确认(OQ)开始前应检查仪器仪表是否在有效期内。
性能确认(PQ)开展前应检查仪器仪表是否在有效期内。
计量或校准要求有两方面的来源,第一个方面国家计量标准要求的强制计量和推荐计量,还有一种是维护仪器已确认的状态。
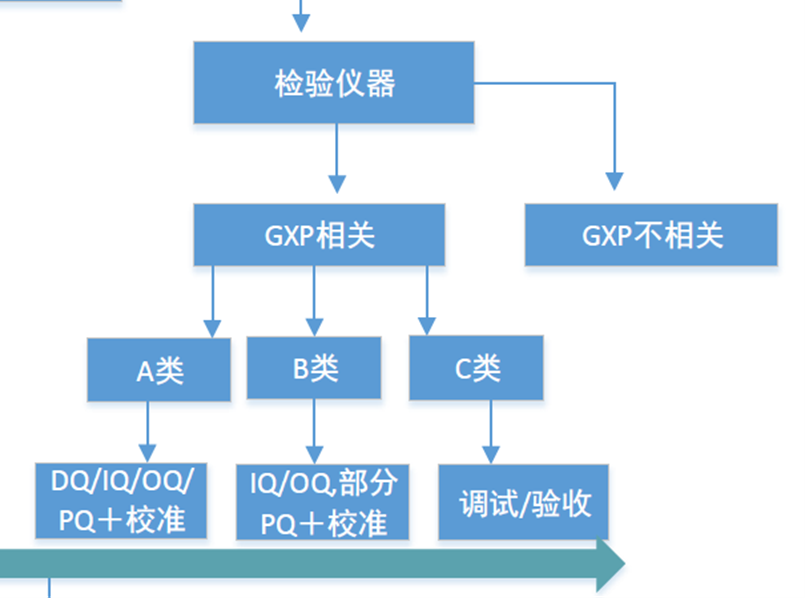
整个仪器的验证策略和流程见下图(仅供参考,还有其他的)
参考:
美国药典1058
计量 --- 厂商有对应活动; 用户也有;
IQ阶段---需要检查对应仪表或设备交付资料; 用户可以在这个阶段要求厂商提供; 如果想执行这一点的话; 建议用户在URS中, 合同中实现进行约定,避免出问题
IQ阶段完成了厂家提供信息; 如果执行的好的用户, 还会对于校准项目和范围,接收标准有要求; 看企业自己
之后, 用户需要梳理好需要校准的仪器和仪表清单(按照企业内部SOP要求进行评估和输出为宜),包括哪些项目, 计量要求范围和或采用的方法; 一般是在OQ前完成计量, OQ同步进行, OQ签署时,计量需要出具报告并合格。这样才是供应商完整的交付;
不过上述要求和动作, 需要各位列在商业采购合同和URS要求中; 避免扯皮
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
