这个问题有两个方面,
1.一个是可比性研究的判断,这个已经有了现有的回答,就不在重复
2.是稳定性的趋势如何判断?这个主要看趋势是否正常,也就是有没有OOT,方法有几种::
经验方法:.目前在药品稳定性试验中广泛使用的用于确认 OOT结果的方法包括:(D连续三个结果超出某一限度; (2)连续结果之间的差异超过了先前结果与质量标准差 异的一半;(3)结果超出了最初结果的±5%; (4)结果 超出了之前结果的±3%: (5)结果超出了之前所有结果 平均值的±5%⑶。
统计方法:回归控制图法,要求有一定的统计学基础,实施计算比较复杂:如果稳定性数据是随着时间降低的,则平均变化值是负值,警戒限应该包括最小值,如果稳定性数据随时间变化是稳定的,则其平均变化值
近似为0,警戒限应该包括上下限,分析警戒是监测实验室错误的,所以建议设定上下限
如,OOT警戒限可以用下述公式来规定: 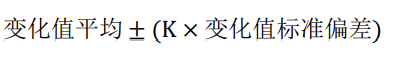
公式中,K是变异系数,一般取K=3(假设数据是正态分布的)或者取t统计量(f,1-α),f代表自由度,α表示显著性水平。上下限度可以取
差异分布的α和1-α的的百分数。这中方法适用于稳定性数据不呈正态分布的情况。
3.MINITAB稳定性的预测功能:(我个人推荐)



最大的差别不能超过预测区间,一般不超过置信区间为好,超过置信区间就可以进行调查。
建议:只要变更后的稳定性可以保证在原先的有效期内符合质量标准,就可以说明变更前后的稳定性具有可比性。
依据:EMA,Stability testing for applications for variations to marketing authorisation
The results of stability studies of the varied active substance/finished product, including the requested time period as defined below, using long term and accelerated* testing conditions, should be compared to studies performed on the unchanged active substance/finished product. This ensures that the change does not negatively impact the stability profile, i.e. that the specification limits of the active substance/finished product will still be met at the end of the proposed retest period/shelf-life. The comparison data of the unchanged product submitted with the variation may come from previous studies.
思考:这个有些类似于ICH Q1A中关于“显著变化”的定义。原料药的显著变化是只超出质量标准,制剂的显著变化是指含量变化超过5%或者其他项目超出质量标准。只要在稳定性期间符合质量标准即可认为无显著变化。
以上仅供参考。
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
