ICH M7中原文:
根据致癌性数据库(CPDB数据库官方名称),环氧乙烷的TD50为21.3 mg/kg体重/天(大鼠)和63.7 mg/kg体重/天(小鼠)。在计算可接受摄入量时,采用了剂量较低的大鼠值(即更保守)。
为推导十万分之一致癌率的剂量,将该值除以50000:
21.3 mg/kg÷50,000=0.42 µg/kg.
推导人类每日总摄入量:
0.42 µg/kg/日×50 kg体重=21.3 µg/人/天。
从以上计算看出,对不同物种(大鼠和人)在终生服用的情况下,如果每天每Kg体重摄入量相同时,各自致癌的风险率就相同,但是大鼠在TD50中实验按照2年最寿命,M7规定人类按照70年。所以这样的话他们的每Kg体重的终生累积服用剂量就相差甚远(35倍!)。这点和指南中指出的Haber法则:认为浓度(C)×时长(T)=常数(k)似乎是相违背的。
我还设想过,是否因为不同物种致癌的敏感度不同,如果是这样的话就多了一个未知系数(实验动物与人类的敏感度比值),所以会导致无法用动物实验的TD50推导出人类致癌剂量,所以也说不通。
毒理学门外汉,请大佬指教。
以下是我查到的信息和一些个人理解,非毒理专业人士,供参考:
ICH M7中注释4从TD50线性外推的示例中有如下描述:“可以根据啮齿类动物致癌效价数据,例如TD50值(导致50%肿瘤发生率的给药剂量相当于患癌风险可能性水平为1:2),来计算特定化合物的可接受摄入量。通过简单地将TD50值除以50000来线性外推至十万分之一的发生率(即可接受的终生风险水平)。该方法类似于TTC使用的推导方法。”
既然“该方法类似于TTC使用的推导方法”,那么我们就来看一下TTC是怎么推导出来的:1984年Peto和Gold等人发表文章[1] [2]建立了CPDB数据库,并首次定义了“TD50”这一用来数值化描述致癌效力(Carcinogenic Potency)的指标,其定义如下“that dose rate (in mg/kg
body weight/day) which, if administered chronically for the standard lifespan of the species, will
halve the probability of remaining tumorless throughout that period.”。Rulis(时任FDA食品安全与营养中心)等人分别于1986、1987、1989年发表文章[3] [4] [5]基于CPDB数据库中343种致癌物数据通过线性外推将致癌效力分布转换为了风险等效暴露-概率分布图(见图1),从而确定了在10-6终生风险水平下50ppb即0.15μg/人/天的建议阈值。1990年Munro等人[6]确认了这一研究,1993年FDA基于此研究确定了10-5终生风险水平下1.5μg/人/天的监管阈值(ToR)[7],也就是目前TTC的来源。ICH M7 注释4中的方法同样来源于此,只不过TTC是根据几百种致癌物的外推数据通过统计而来,注释4这个方法是根据某化合物的特定TD50外推而来。
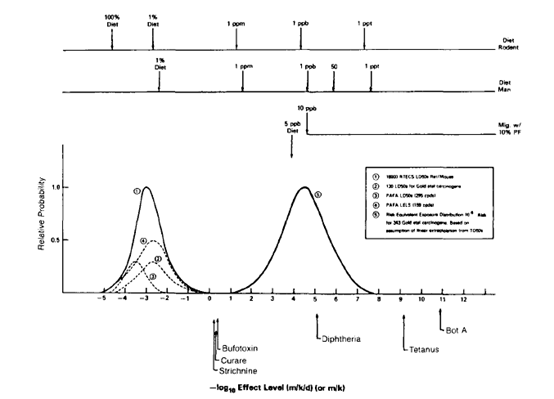
图1
在Rulis等人的文章中对于致癌效力分布的转换过程中有一个假设“using the simple assumption that low-dose risk equals potency times
exposure (where, for the purposes of this discussion, potency is taken to be
the slope of a straight line connecting zero risk/zero exposure to a point
corresponding to a risk of 0.5 at the TD50 dose of Gold et al”,也就是风险=效力*暴露,其中效力取自(TD50,0.5)与0点所作直线的斜率。所以,我的理解这个假设就是简单的认为在动物和人之间每单位剂量率导致的终生致癌风险是一致。那么这个假设有什么依据呢?
其实在1984年Peto和Gold等人定义TD50这一致癌效力指标之前或之后,有很多人都提出了致癌效力的数值化指标,只不过可能TD50和LD50更为相似,所以普遍被大家接受。所以关于物种间致癌效力转换的讨论在这个方法建立前后一直都存在,几十年来有大量的文章都讨论了这一话题,结论各不相同。其中在TD50建立前后也有部分研究(比如1979年Crouch等人[8],1988年Allen等人[9],1991年Goodman等人[10],1992年Gold等人[11])得出了人和啮齿动物之前的致癌效力是趋同的。比如1991年Goodman等人的文章中定义了KhR作为从啮齿动物到人的致癌效力转换因子(其中大鼠到人为Khr,小鼠到人为Khm),该文章提到FDA的决策者认为Khr=Khm=1,而EPA(美国环保署)的决策者认为Khr=5.9,Khm=,13。Goodman等人通过对Allen等人的研究数据[9]进行再次分析后认为(见图2 实线1,点线5.9,虚线13),EPA将啮齿动物到人的致癌效力转换因子高估了,更认可KhR≈1的结论。

图2
但是动物和人之间的致癌效力究竟怎么换算这是一个很难说的清的问题,对于你问题中关于人和动物寿命不同的疑惑,可能Goodman文章中的一段对于致癌的生物学机理的讨论可以给你一些启示:“假设人类和小鼠的所有组织在例如受到电离辐射的均匀轰击时都同样可能发生肿瘤。因此,人类在任何给定时间段内患肿瘤的概率都比小鼠大(仅仅因为有更多的组织),比率为Mh/Mm,Mh和Mm分别代表人类和小鼠的质量。现在众所周知,癌症的发病率会随着年龄的增长而增加,时间的幂次方取决于恶性肿瘤的类型。让我们假设是4次幂, 那么在小鼠的一生Tm中发生肿瘤的概率比在人类一生Th期间发生肿瘤的概率小,即 (Tm/Th)4。 因此,我们预计小鼠辐射诱发癌症的终生发病率将比人类低的因子约为:(Mm/Mh)(Tm/Th)4 = (30 g/70 kg)(2 年/70 年)4 = 1/109。然而有证据表明,辐射诱发癌症的小鼠/人类实际比例更接近一致。 我们都知道这个悖论的答案:这是因为导致致癌的生化和生理事件在小鼠中比在人类中进行得更快。较小动物的细胞分裂速度更快。小鼠的心输出量是每分钟总血量的 100%,而人的心输出量仅为每分钟血量的5%。这些以及其他因素,无论是已知的还是未知的,都会导致肿瘤诱导的不同概率和滞后时间,以及不同的剂量反应。“[10] 所以,从这个角度来看,我们如果要弄清楚不同物种间的致癌效力的话也不能只考虑寿命的不同,对于某一特定化合物,所有关于其吸收速率和机制的差异、向靶器官的分布、生化转化为活性或非活性代谢物、清除和致癌机制等信息都应予以考虑。我认为您提到是否需要考虑寿命的换算可能对于同一物种同一化合物的致癌效力可能更为适合,就像ICH M7中提到的LTL暴露计算。
其实,ICH M7推荐的简单线性外推这一方法是相当保守的,有以下几个方面:
(1)
TD50的计算过程中采用了很多保守的假设;
(2)
线性外推采用了考虑最敏感的物种、部位、性别等因素的TD50;
(3)
在相同风险水平下,简单的直线线性外推要比一些其它的外推方法比如线性多阶段外推(LMS)的得出的剂量要低(见图3);[12]

图3
(4)
这种方法并没有考虑人类的防御机制而设置一个无剂量反应的阈值,通过外推得到的量极低对于某一化合物可能早已在这个阈值之下了;
希望这些对你理解这一方法“背后的逻辑”有帮助,其实这个方法是建立在很多假设的基础之上,可能并不需要那么精确的计算或换算。包括终生致癌风险10-5虽然是建立在统计数据的基础上,但最终的确定也是有一些主观成分的,认为这个风险足够可以接受。
如有错误或不足请指出,谢谢
参考文献
[1] Peto R., Pike M. C., Bernstein L., Gold
L. S. and Ames B. N. (1984) The TD50: A proposed general convention for the
numerical description of the carcinogenic potency of chemicals in
chronic-exposure animal experiments. Environmental
Health Perspectives 58, 1-8.
[2] Gold L. S., Sawyer C. B., Magaw R.,
Backman G. M., de Veciana M., Levinson R., Hooper N. K., Havender W. R.,
Bernstein L., Peto R., Pike M. and Ames B. N. (1984) A carcinogenic potency
database of the standardized results of animal bioassays. Environmental Health Perspectives 58, pp.9-319.
[3] Rulis A. M. (1986) De Minimis and the
threshold of regulation. In Food
Protection Technology, ed. C. W. Felix, pp. 29-37. Lewis Publishers Inc.,
Chelsea, MI.
[4] Flamm W. G., Lake R. L., Lorentzen R.
J., Rulis A. M., Schwartz P. S., and Troxell T. C. (1987). Carcinogenic
potencies and establishment of a threshold of regulation for food contact
substances. In De Minimis Risk (C.
Whipple, Ed.), pp. 87-92. Plenum, New York.
[5] Rulis A. M. (1989) Establishing a
threshold of concern. In Risk Assessment
in Setting National Priorities, ed. J. J. Bonin and D. E. Stevenson, Volume
7, pp. 271- 278. Plenum Press, New York.
[6] Munro I. C. (1990) Safety assessment
procedures for indirect food additives: An overview. Report of a workshop. Regulatory Toxicology and Pharmacology
12, pp.2-12.
[7] Munro I. C.,Kennepohl
E. and Kroes R. (1999) A Procedure for the Safety Evaluation of Flavouring
Substances. Food and Chemical Toxicology
37, pp.207-232.
[8] Crouch, E., and Wilson, R. (1979) Interspecies
comparisonof carcinogenic potency. J.
Toxicol. Environ. Health 5, pp.1095-1118.
[9] Allen, B. C., Crump, K. S. and Shipp,
A. M. (1988) Correlation between carcinogenic potency of chemicals in animals
and humans. Risk Anal. 8, pp.531-544.
[10] Goodman G. and Wilson, R. (1991) Predicting
the Carcinogenicity of Chemicals in Humans from Rodent Bioassay Data. Environmental Health Perspectives 94, pp.195-218.
[11] Gold L. S., Manley N. B. and Ames B.
N. (1992) Extrapolation of Carcinogenicity Between Species: Qualitative and
Quantitative Factors. Risk Anal. 12, pp.579-588.
[12] Krewski D., Szyszkowicz M. and
Rosenkranz H. (1990) Quantitative factors in chemical carcinogenesis: Variation
in carcinogenic potency. Regulatory Toxicology
and Pharmacology 12, pp.13-29.
TD50值线性外推是基于啮齿动物的最敏感部位的致癌性数据,通过除以50000线性外推至十万分之一的患癌概率;这个外推确实是没有考虑物种和器官的差异的,但不考虑也是更保守的结果,人类相对于啮齿动物而言,肯定剂量是更耐受的;
当然M7 Note4 中也有描述:使用啮齿类动物致癌性研究中最保守的 TD50 值并不不考虑其与人类相关性的,作为该方法的替代方案,可以对已有致癌性数据进行深度毒理学专家评估,以便首先确定与人 类风险评估相关性最高的发现(例如,物种,器官),作为推导线性外推参考点的依据。
深度毒理学评估后,推导出线性外推的起点值,但明显会比较复杂。
因此,简单粗暴的TD50外推,除以50000,大家不爱吗? 毕竟外推算得的数据比保守的TTC通常要大的,在分析手段日新月异的今天,相信这不是难到我们制药人的关键。
感谢您的解答。不过我的疑问还是在,即“对不同物种(大鼠和人)在终生服用的情况下,如果每天每Kg体重摄入量相同时,各自致癌的风险率就相同,但是大鼠在TD50中实验按照2年最寿命,M7规定人类按照70年。”
即使TD50“是基于啮齿动物的最敏感部位”,属于保守结果,但物种和器官差异无数据,因此也未知保守结果是否能抵消人类的终生累积摄入量是啮齿类动物的35倍所增加的风险。
我关注这个问题的原因的是:如果以上我想的是对的,那么按照这个算法外推得到人类的可接受摄入量对应患癌风险将可能大于十万分之一。
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
