2个回答
回答:
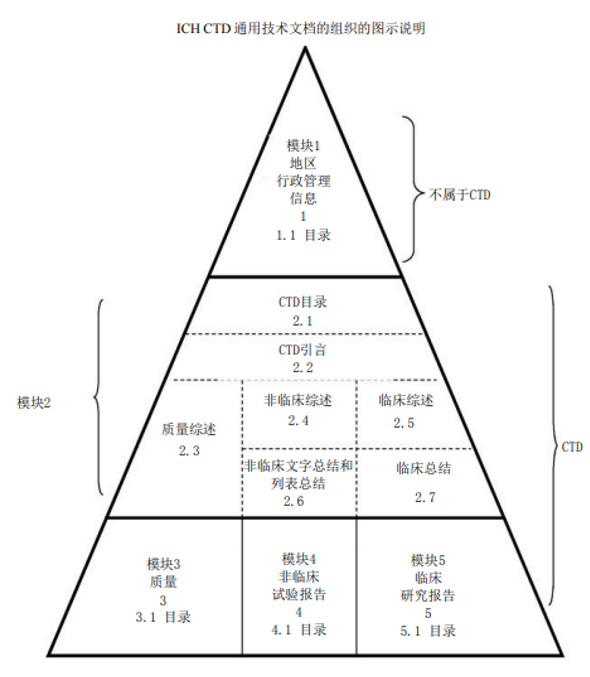
不需要,按照《药品注册管理办法》及《生物制品 注册 分类 及申报资料要求》的规定,提供符合要求的申报资料。申报资料应根据《 M4:人用药物注册申请通用技术文档 CTD)》(以下简称 CTD)整理,目录及项目编号不能改变,对应项目无相关信息或研究资料,项目编号和名称也应保留,可在项下注明“不适用”并说明理由。

依据
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
这{{threadTextType}}正{{isAdminText}}
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
