3个回答
回答:
可以变更,根据《生物制品变更受理审查指南(试行)》药物临床试验期间,发生药物临床试验方案变更、 非临床或者药学的变化或者有新发现的,申办者应当按照规定,参照相关技术指导原则,充分评估对受试者安全的影响,可能增加受试者安全性风险的,应当提出补充申请。 若申办者同时发生变更的 ,由变更后的申办者提交补充申请 ,并提交相关证明性文件 ;若注册代理机构同时发生 变更 的,应提供境外申请人解除原委托代理注册关系的文书、公证文书及中文译文。
相关的申报资料要求参照指南要求。
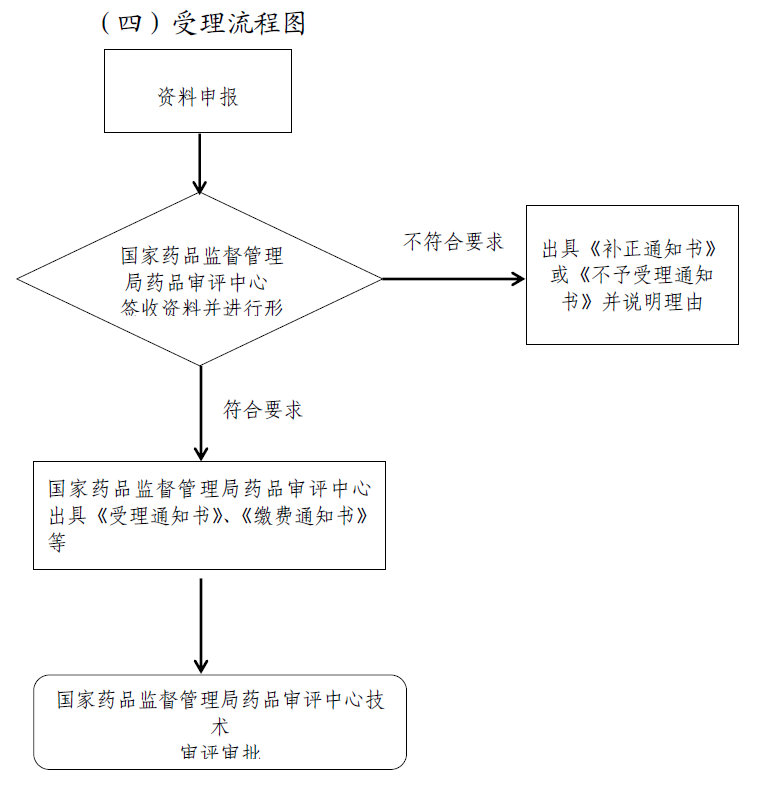
依据:
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
这{{threadTextType}}正{{isAdminText}}
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
