3个回答
【建议与思考】
1、首先要明确开展原料药光稳定性的目的是什么?考察其强光降解情况?为贮藏、运输条件提供支持信息?。。。
2、不同研究目的以及不同的药物光稳定性,可以有不同的试验设计。
3、对于原料药可以根据需求采用系统的光稳定性测试方法,酌情涵盖以下研究:
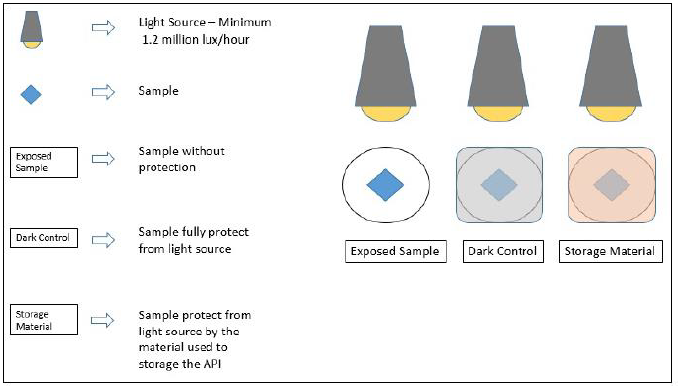
i) 原料药直接试验;
ii) 原料药+直接接触包装材料试验;
iii) 原料药+直接接触包装材料+其他对光有防护作用的包装进行试验;
iv) 模拟市售包装进行测试。
4、药品测试的范围应通过评估在光照测试结束时是否发生可接受的变化来确定,详见ICHQ1B药品光稳定性测试决策流程图中所述。可接受的变化是在合理的范围内的变化。
5、对光不稳定的原料药和药品的正式标签要求需根据注册目标国家/地区要求制定。
6、关注注册目标国/地区的一些特殊要求,如巴西。
【依据】
1、
2、 巴西Resolution-RDC
No.45, RDC 318/2019
以上信息希望对你有帮助
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
这{{threadTextType}}正{{isAdminText}}
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
