第一次做进口原料药注册代理,后续需申请注册检验,故先理论学习和梳理进口原料药注册检验申请的方式与流程,待实操后再进一步完善总结。
首先,不是在国家局网上办事大厅【注册检验】申请,而是在中检院官网办事大厅处的【进口药品注册检验】进行申请,截图如下:
【进口药品注册检验】左边的【检验业务】已经整合到国家药品监督管理局网上办事大厅,容易产生误解找错地儿。
点进【进口药品注册检验】显示如下:
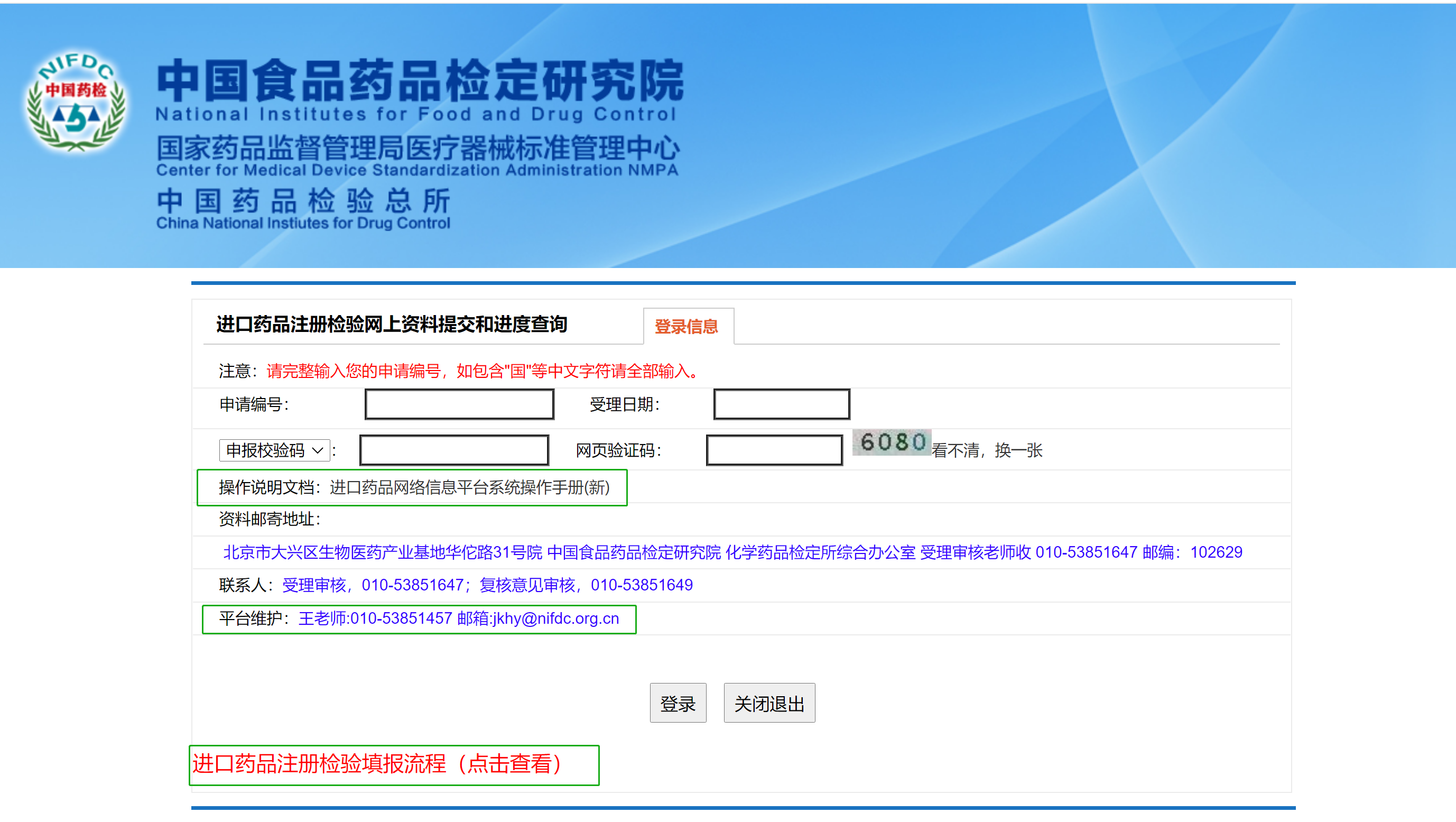
有资料邮寄地址、受理审核和平台维护老师的联系方式,以及两份粗犷的【进口药品注册检验填报流程】和【操作说明文档:进口药品网络信息平台系统操作手册(新) 】 ,需查阅知晓,但仅根据这两份文件不足以支撑完成注册检验申请。
接下来详细说明原料药登记拿到CDE出具的受理通知书、注册检验通知书后,注册检验申请的流程:
①将注册检验通知书和受理通知书邮件发送至平台维护王老师邮箱jkhy@nifdc.org.cn(发送前注意核实官网是否更新邮箱),同时提供以下信息:
------------------------------------------------------------
药品基本信息:
申请编号
原料药登记号(如果不是原料药不用填写,如:Y20200000888)
国家局受理日期
CDE检验通知书日期
通用名称(中)
通用名称(英)
申报商品名(中)
申报商品名(英)
剂型
规格
包装规格
申报校验码
------------------------------------------------------------
厂商基本信息:
厂商国家或地区
厂商名称
生产厂国家或地区
生产厂名称
包装厂国家或地区
包装厂名称
------------------------------------------------------------
代理机构基本信息:
机构名称
组织机构代码/统一社会信用代码
法定代表人
法定代表人职位
注册地址
注册地址邮编
通讯地址
通讯地址邮编
注册负责人
注册负责人职位
联系人
联系人职位
联系人电话
传真
电子信箱
手机
-----------------------
(以上信息如果部分项没有,则在该项后填写“无”;如有需要补充的信息请附在最后面。)
②老师信息核实后会以邮件方式提供登录信息;
有了登录信息,登录进去后按照流程走,后续申请流程其实就明朗了
③登陆后阅读注意事项,填写申请表,电子上传资料,资料清单如下:
④按审核意见补充资料,寄送加盖公章的纸质资料以及3批一倍检验量样品和对照品至中检院;
⑤中检院完成资料审核后会分配承检机构。
⑥与承检机构沟通,提供资料、3批两倍量样品、对照品、色谱柱以及其他需要的物料等等。
以上完成原料药进口注册检验申请。
草拟于不用打工的一个工作日~
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
