开放之窗(Open Window):自己知道,他人也知道。known knowns
盲点之窗(Blind Window):自己不知道,他人却知道。known unknowns
隐蔽之窗(Hidden Window):自己知道,他人不知道。unknown knowns
未知之窗(Dark Window):自己不知道,他人也不知道。unknown unknowns

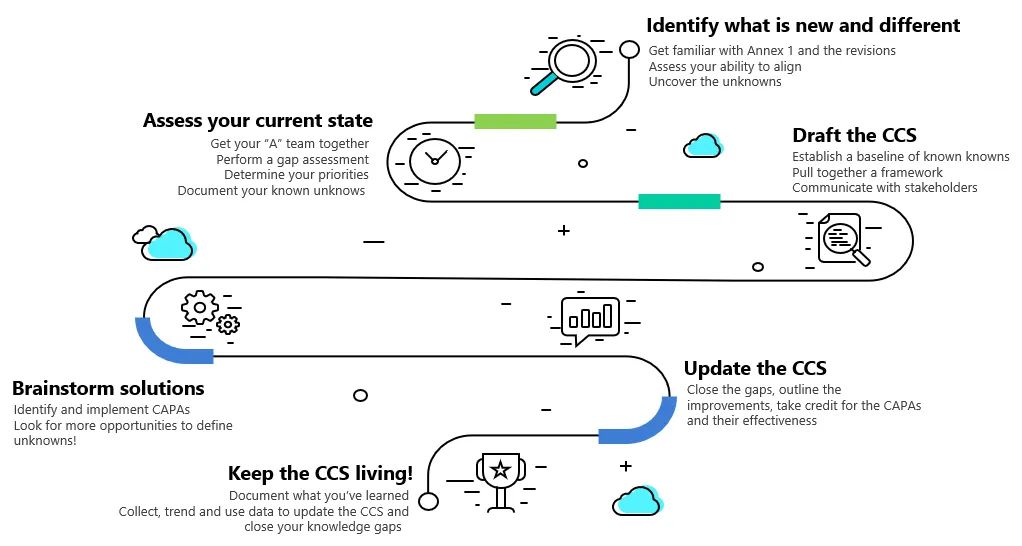
识别新的和不同的地方:发现未知
评估当前状态:记录盲区 known unknowns
集体讨论解决方案:调查并缩小知识差距
结论
附录1的修订揭示了对风险管理的重新重视和对污染控制的积极反应。合规之旅应包括一个强有力的战略计划,该计划将质量体系作为促成因素,并基于风险进行决策,以确定所收集知识的优先级。目标是打开乔哈里视窗,以确保随着时间的推移,自己未知的未知事物的数量最小化,而让自己已知的事物的数量增加。
作者:Shengyi
来源:拾西
公众号日期:2022年9月20日
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
