药品注册检验包括样品检验和标准复核,《药品注册检验工作程序和技术要求规范(试行)(2020年版)》规范药品注册检验工作程序,明确注册检验技术要求。在实务操作中,对于进口药品注册检验流程和要求中,发现还有很多细节容易出现问题。笔者根据规范要求及实际经验总结了进口药品注册检验的通用流程与要求,供大家学习、参考。
1、
送检前准备工作:
1)中检院送检账号开通
l 在中检院网站:https://www.nifdc.org.cn/nifdc/
点击

l 找到平台维护老师联系方式后,通过电子邮件告知对方需要进行进口的需求。
平台维护:黄老师 电话:18515623110 邮箱:18515623110@163.com
l 根据老师回复邮件填写平台账号开通所需信息(通常1-3日内会收到回复邮件)
l 账号开通后,平台维护老师会邮件告知(通常通常1-3日内会收到)
2)在送检前应确认所有方法可以完好重现,如有问题,应及时和生产商沟通,并解决。
2、
根据药品注册检验通知书或发补需求提交准备送检的样品和资料。
3、
送检资料包括如下10项内容:
1)《网上确认表》(经办人签字)、《境外生产药品注册检验资料目录》、《受理通知单》(复印件)、《进口药品注册申请表》(复印件)(前置注册检验除外)、进口通关凭证、检验通知单(原件)或补充资料通知
l 《网上确认表》(经办人签字)、《境外生产药品注册检验资料目录》在线填写、打印即可。
l 对于原料药,没有《进口药品注册申请表》,需提供进口原料药登记表
l 检验通知单:请注意纸质版必须是原件。
2)按照现行版《中国药典》格式整理的质量标准及起草说明
3)送检样品按申报质量标准出具的出厂检验报告书(中、英文版)
4)企业随送检样品提供的标准物质(对照品)的检验报告书及相关研究资料(中、英文版)
5)药品通用技术文件(CTD)资料:模块2(概要)中2.3(质量总体概述)(中、英文版)
6)模块3(药学研究资料)(中、英文版)
7)其他必要的药学研究资料
8)原料药随制剂同时申请上市许可的,应按上述要求同时提供原料药和制剂的资料
9)上市批准后补充申请注册检验,还需要提供已批准的药品注册标准
10)
样品、对照品等清单
l 该清单如果涉及色谱柱提供,也需罗列。
l 3倍量样品和对照品:每1倍量检测用样品和对照品均需单独包装。
l 首次检测,样品和对照品在中检院和口岸所接收时,剩余有效期或复验期至少满足180个工作日,约10个月;考虑送检过程的耗时,建议至少15个月左右。
4、
登录具体产品账号,按界面要求填写申请基本信息。
l 药品信息:申请编号(即登记号)、受理日期、通用名称、包装规格等
l 生产商信息:生产商+包装厂名称和区域等
l 代理机构信息:名称、组织机构代码、注册地址、通讯地址、联系人等
4、按照境外生产药品注册检验用资料目录逐项提供送检资料。
l 申请人提供的药品注册检验用资料,应与提交至药品审评中心的资料一致。
l 资料名称不应过长,其不能包含特殊符号。
注意事项:
1)申请人请在进口药品注册检验平台填报电子版注册检验资料,收到反馈的审核意见后,按审核意见寄送纸质版资料及样品等。
2)补充检测时,建议申请人在提交的现行版中国药典格式拟定标准中,醒目划注本次注册检验中涉及的标准物质,并核实用量。
3)建议申请人按照《关于(品种名)(受理号)审核意见的回复》为题,以问答形式简明扼要逐条回复审核意见,该回复上传至资料目录其他项,补充资料上传至相应条目。
4)已在药品审评中心公示的临床急需品种、优先审评品种,治疗国家卫健委公布的《关于公布第一批罕见病目录的通知》病症的药品,儿童用药等品种,申请人请在申请同时主动告知并提供证明材料。
5、中检院资料审核(5个工作日)
l 如送检资料存在问题,通常会电话告知,后续刷新平台信息,会看到提示需要补充的具体信息。
l 电话告知信息可能和平台显示信息并不完全一致,需以平台显示信息为准。
l 根据提示在线提交补充资料,中检院进行二次资料审核(通常5个工作日)
l 如资料审核没有问题后,平台会显示:请提供1倍量样品对照品和纸质资料至中检院。
6、1倍量样品对照品和纸质资料递交
l 可现场提交,也可以通过邮件直接寄送
l
资料邮寄地址:北京市大兴区生物医药产业基地华佗路31号院 中国食品药品检定研究院 化学药品检定所综合办公室 邮编:102629
l
联系人:李老师(受理审核,电话:010-53851647),魏老师(复核意见审核,电话:010-53851649)
7、复核信息流程如下:
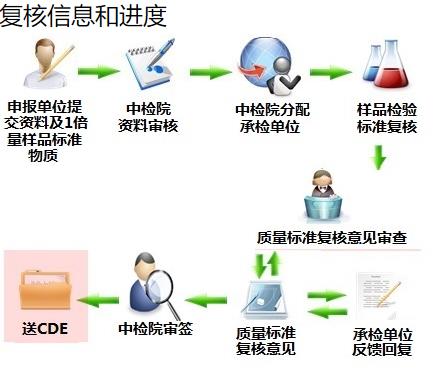
1)中检院资料审核没有问题的话,会分配承检单位(通常5个工作日)。
2)承检单位接到任务分配后通常1-5个工作日内会给送检单位打电话。
3)根据承检单位老师电话要求提交2倍量样品、对照品、纸质资料以及其他注册检验所用色谱柱或特殊试剂等。
4)口岸所业务处老师接收送检资料(含样品等),如无问题,出具送检凭证。
5)口岸所业务处分配检验工作至具体科室(建议密切跟进,分配时间有时较长)。
6)具体科室老师如认为需进一步补充资料(含对照品等),会电话告知或出具补充资料通知函。
注:不同口岸所流程可能略有差异,也可能在业务处受理阶段出具补充资料通知函。
7)根据补充资料要求回复,并提供补充资料(含对照品等)。
8)需跟进口岸做样品检验标准复核不同科室的进度,包括理化项目、微生物室(微生物+内毒素)。有任何问题应及时沟通反馈,解决。
9)口岸所完成送检后,反馈中检院,中检院分配专家审核,通常1月只有一次专家审核会。
10)
专家分配后,审核时限20个工作日。如有修订意见,回返回口岸所;口岸所修订的后,中检院重新专家审核。
11)
质量标准复核意见反馈企业。
12)
中检院签审,时限通常为10个工作日。
8、二次注册检验:
l 如需二次注册检验,CDE会发书面通知给注册申请人。
l 接到通知后,应在中检院找到平台维护老师联系方式后,通过电子邮件告知对方需要二次注册检测的需求。
平台维护:黄老师 电话:18515623110 邮箱:18515623110@163.com
l 按照1(1)中检院会重新给企业开通注册注册检验的账号信息,再按照初次注册检验流程操作。
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
