作者|唐溱 赵晓霞 关宏峰 张永文( CDE)
来源|中国新药杂志 2021.11
抑菌剂作为非固体制剂中常见的附加剂,对防止药品微生物污染和保证药品质量具有重要作用。由于抑菌剂具有一定毒性,应严格控制应用范围和用量。通过查阅《中华人民共和国药典》2020 年版和欧洲EMA 指导原则,本文总结了我国和EMA 对药品中使用抑菌剂的相关要求,提出药物研发中使用抑菌剂应关注必要性和用量等问题,对抑菌剂的适用范围进行了思考和探讨,旨在为药品研发提供参考。
EMA 对人用药品中抑菌剂( preservatives) 的相关研究有特别的规定,目前主要参考《Guideline OnExcipients In The Dossier For Application For Marketing Authorisation Of a Medicinal Product》( EMEA/CHMP /QWP /396951 /2006) [6],该指导原则阐述了含抑菌剂药品在上市许可申请时需提交的资料,同时对抑菌剂使用的总体原则提出了建议。ChP2020 在制剂通则和抑菌效力检查法等内容中对抑菌剂使用的原则做了规定。EMA 和ChP2020 对抑菌剂使用的总体要求见表1。

我国虽然没有明确要求含抑菌剂制剂在上市许可申请时需提交的研究资料,但对抑菌剂使用的总体要求与EMA 基本一致,包括: ① 应具有充分的理由。② 制剂中抑菌剂的量应为最低有效量。③ 有效性( 抑菌效力) 和安全性应符合要求。此外,针对不同制剂或用药人群等特点,对抑菌剂的使用及用量也有其他具体的考虑和规定,制剂在研发过程中均应予以关注。
通常含水分多的制剂受微生物污染的风险较大,如口服溶液剂、混悬剂、乳剂、外用液体制剂、乳膏剂及可多次使用的无菌制剂( 如多剂量滴眼剂等) 。一般对于多剂量包装、药物本身不具有充分抑菌效力的非固体制剂,研发时需进行相关研究,考虑添加适当抑菌剂。对于口服溶液,根据制剂中的水活度确定是否需加抑菌剂是目前处方研究的共识,美国药典中收载了关于水活度测定及应用的一般要求。对于酒剂、酊剂和煎膏剂( 膏滋) 等含有高浓度乙醇或较高渗透压的剂型,制剂本身具有一定防腐作用,可考虑研究不加抑菌剂。此外,对于眼用制剂、注射剂以及儿童用药需重点关注抑菌剂使用的合理性和安全性。
2.1 眼用制剂
研究表明绝大多数抑菌剂对眼部均有不同程度的刺激,长期使用可导致眼部炎症、过敏、纤维化和干眼症等。对于滴眼剂等剂型,常采用多剂量包装,以防止使用过程中由于微生物污染和繁殖导致药品变质而对患者造成危害,ChP 2020 对于多剂量眼用制剂的建议还是应适当使用抑菌剂,并尽量选用安全风险小的抑菌剂。但对于眼内注射溶液、眼内插入剂、供外科手术用和急救用的眼用制剂,ChP 2020 规定不得加抑菌剂,且应采用一次性使用包装。
对于抑菌剂不耐受患者、治疗周期较长、儿童尤其是新生儿,抑菌剂的使用会带来较高风险,EMA建议治疗此类患者应首选不含抑菌剂的眼用制剂,若必须使用,对所选用抑菌剂应有充分的理由,同时建议进行适当的非临床和临床研究设计以确保制剂理想的获益/风险[7]。
对于多剂量包装的抗生素类眼用制剂是否需要加入抑菌剂、加入何种类型的抑菌剂,目前业界普遍共识是应根据具体品种特点( 如抗菌谱等) 进行综合评价后确定。有研究显示部分抗生素滴眼液,特别是喹诺酮类滴眼剂,不加抑菌剂也可以满足抑菌效力检查法的要求[8]。ChP 2020 规定眼用制剂在启用后最多可使用4 周,考虑到用药安全,若没有充分理由应考虑添加适宜的抑菌剂。
2.2 注射剂
大多数注射剂是经过无菌控制且采用单剂量包装,一般无需加抑菌剂。国家药品监督管理局药品审评中心于2018 年公开征求《药物注射剂研发技术指导意见》意见,其中明确注射剂中应对抑菌剂的使用严格控制,原则上不建议使用抑菌剂。必须加入抑菌剂的注射剂,应建立抑菌剂的质量要求,并按照《中华人民共和国药典》现行版要求提供抑菌效力验证结果及安全性的综合评价。ChP2020 注射剂通则下列出的常用抑菌剂包括0.5%苯酚、0.3%甲酚、0.5%三氯叔丁醇、0.01%硫柳汞等。同时,ChP 2020 规定静脉给药与脑池内、硬膜外、椎管内用的注射液中禁止加抑菌剂。
2.3 儿童用药
儿童相比成人在器官和代谢发育方面还不成熟,抑菌剂在儿童体内的药动学特征与成人有所差异,使用不当可能会带来安全性问题。海莉丽等[9]报道苯甲醇可能导致儿童产生代谢性酸中毒、哮喘、癫痫发作及接触性皮炎等不良反应,还会增加新生儿高胆红素血症的风险; 苯扎氯铵局部应用于耳部可产生耳毒性、皮肤刺激,还会诱发过敏性哮喘患者的支气管收缩; 对羟基苯甲酸酯类可引起新生儿高胆红素血症及药物刺激性、过敏反应、雌激素效应等; 苯甲酸钠可导致荨麻疹及新生儿高胆红素血症的风险增加。
EMA 建议儿童用药应尽可能避免使用抑菌剂,当然对于口服给药制剂的研发,该因素也不应是决定剂型是液体或固体的唯一考虑。对于眼用制剂,为避免抑菌剂对眼角膜及黏膜产生潜在的局部毒性,尽可能选择单剂量包装或专用多剂量容器等可免用抑菌剂的包装方式,这对用于新生儿或使用周期较长的药物尤为重要。若必须使用抑菌剂,在满足抑菌作用的前提下应为最低浓度,并且在风险/获益平衡方面是合理的[6,10]。
此外,食品领域相关的法规指南也应纳入考虑。例如,羟苯丙酯目前没有明确规定每日最大摄入量( acceptable daily intake,ADI) ,欧盟食品法规中也不推荐使用,另有研究显示其会影响雄性大鼠生殖器官,因此在治疗周期较长的儿童制剂中应慎重使用[11-12]。
3 抑菌剂用量的考虑
抑菌剂的用量影响着药品的安全性,用量不足会导致微生物污染,过量又可能引起安全性风险。抑菌剂的用量应从有效性( 抑菌效力) 和安全性进行考虑。
3.1 抑菌剂用量的有效性抑菌剂用量应使制剂的抑菌效力符合规定,保证制剂在放置过程中符合微生物限度的要求。我国从ChP2010 开始收载抑菌效力检查法,该方法用于测定无菌及非无菌制剂的抑菌活性,以指导生产企业在研发阶段确定制剂中抑菌剂的浓度。如需加抑菌剂,除另有规定外,ChP 要求处方的抑菌效力应符合“抑菌效力检查法”的规定,同时应验证制剂的抑菌效力在效期内不因贮藏条件而降低。
相比ChP2010,ChP2015 对该方法中抑菌效力判断标准进行了修订( ChP 2020与ChP2015 基本一致) 。杨晓莉等[13]研究探索了硫酸软骨素滴眼液中抑菌剂的合理添加剂量,分别按ChP2010 和ChP2015 抑菌效力检查法测定,结果显示按ChP 2010,滴眼液对试验菌的抑菌性符合药典要求,而按ChP2015 则不符合要求,可见ChP2015 相比ChP2010对抑菌效力的要求更严格。
3.2 抑菌剂用量的安全性
为保证抑菌剂的安全性,ChP 2020 要求成品制剂中的抑菌剂有效浓度应低于对人体有害的浓度。EMA 建议以文献和/或实验数据为依据说明抑菌剂及用量的安全性,除非抑菌剂是常见的并且通常以相同浓度和相同给药途径使用[6]。
一般情况下,抑菌剂的用量应该在国内外公布的抑菌剂常用量范围内。ChP 2020 规定糖浆剂和合剂中山梨酸和苯甲酸的用量不得过0.3% ( 其钾盐、钠盐的用量分别按酸计) 、羟苯酯类的用量不得过0.05%。EMA 公布的苯甲酸及苯甲酸盐常用浓度为0.01% ~ 0.2%[14],苯扎氯铵在眼用溶液中常用浓度为0.01% ~ 0.02%[15]。
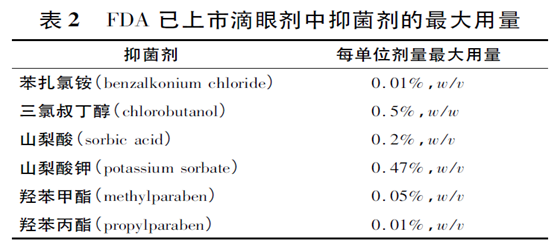
美国FDA 对已上市药品中非活性成分在单位剂量的最大用量进行了汇总[16],表2 列举了滴眼剂( drops) 中常用抑菌剂的最大用量。抑菌剂同时也作为食品添加剂,世界卫生组织食物添加剂联合专家委员会( JECFA) 对常用抑菌剂的ADI 也了限量规定( 表3) [12],口服制剂若添加抑菌剂可参考有关限量规定。当制剂中抑菌剂用量超过了国内外公布的最大量时,还应慎重考虑安全性问题。

4 抑菌剂影响因素的考虑
诸多因素会影响抑菌剂在制剂中发挥作用,研发过程中应综合这些因素选择适宜的抑菌剂种类及用量,保证药品在放置过程中的抑菌效力不会明显改变,同时不会因为化学成分的相互作用影响药品的安全性和有效性,一般应考虑以下因素[2, 17]。
4.1 辅料
例如重金属等会加速山梨酸的氧化,而甘油、丙二醇等与山梨酸联合使用则能产生协同作用。此外,表面活性剂、抗氧化剂、碱性化学成分和枸橼酸盐等也会影响不同抑菌剂的抑菌作用。
4.2 制剂理化性质
以苯甲酸为例,苯甲酸及其盐的抑菌活性受pH 值影响较大,pH > 5 时抑菌效果会明显降低。苯甲酸在混悬剂中会解离,阴离子会吸附于混悬药物粒子上,导致粒子表面电荷分布改变,从而影响混悬剂的物理稳定性。
4.3 包装容器
塑料类容器对某些抑菌剂( 如对羟基苯甲酸酯类) 会产生吸收,还会因吸附使抑菌剂在容器内表面产生较高浓度,影响抑菌效果; 氯丁二烯橡胶塞、丁基橡胶塞还可缓慢吸附苯甲醇。
4.4 药物成分
梁小雯[18]以兔角膜上皮细胞考察了冰片和抑菌剂长期合用对细胞的损伤,结果显示冰片在一定程度上加大了抑菌剂对眼部的损伤,提示冰片的促渗透作用可能会增加眼用制剂中抑菌剂的安全风险。
多剂量制剂在开封后,反复使用中的环境因素也会对抑菌剂的抑菌效力产生影响。EMA 建议含有抑菌剂的多剂量制剂,还应考察在模拟使用条件下抑菌剂的有效性[6]。ChP 2020 对药品包装开启后的抑菌效力检查无相关要求,也没有相应的试验方法及抑菌效力判断标准; 但对于多剂量包装的无菌制剂,应考虑和关注进行相关的微生物挑战试验。
5 抑菌剂质量控制的考虑
抑菌剂的质量控制一方面是对抑菌剂本身的质量要求,另一方面是对制剂中抑菌剂的质量控制。
5.1 抑菌剂的质量要求
一般情况下,药品中使用的抑菌剂应该满足药用要求。部分已上市制剂中的抑菌剂目前仍没有药用标准,生产企业应该研究相应的企业标准,保证抑菌剂的质量稳定可控。ChP2020 四部新增了苯甲酸、苯氧乙醇、间甲酚等的药用辅料标准,应注意符合Chp 的相关要求。
5.2 制剂中抑菌剂的质量控制
EMA 和人用药品注册技术要求国际协调会( ICH) 建议在药品质量标准中应建立抑菌剂的定性和限量检查。ICH Q6A指南建议,对需加入抑菌剂的口服液体制剂/非肠道给药制剂,应制定抑菌剂的含量认可标准,标准应能保证制剂在整个使用期间和货架期内微生物限度在合格范围内,出厂检验中通常要进行抑菌剂的含量测定。
ChP 从2015 年版开始增加对注射剂和滴眼剂中抑菌剂的控制要求,在部分品种的质量标准项下要求测定抑菌剂,但对于其他剂型的非固体制剂,ChP 2015 没有明确要求。国内相关指导原则[19]建议在制剂稳定性研究中,必要时应进行初步稳定性试验( 增加抑菌剂含量检测) ,以确认产品有效期时抑菌剂的功效。从ChP 的要求来看,在药品质量标准中增加抑菌剂的定性和定量检测是具有重要意义的,研发过程中应关注.
6 抑菌剂标示信息的考虑
药品说明书中辅料的标示信息对临床医生和患者合理使用药物具有重要意义,便于医生和患者了解所用药物的辅料情况,避免引起不良反应或与其他主药成分相互作用的可能,为临床用药安全性提供参考,也为药物不良反应分析提供依据。ChP 2020 要求对含有抑菌剂的眼用制剂和注射剂,产品说明书、标签中应标明抑菌剂的种类和浓度。
王琛等[20]抽查了眼用制剂说明书中抑菌剂名称和含量的标注情况,结果显示国产眼用制剂的标注率不足30%,而进口眼用制剂可达到70% 以上。由此可见我国在完善药品说明书信息方面还有待提高,眼用制剂和注射剂在药品上市注册申请时,应关注说明书、标签中抑菌剂标示的相关信息,按要求进行标示。
7 小结
综上所述,抑菌剂作为非固体制剂中常用的附加剂,对保证制剂质量具有重要作用。由于抑菌剂对人体存在安全性风险,其相关研究相比其他辅料有更高的要求。结合《中华人民共和国药典》和欧盟EMA 指导原则中的相关规定,新药研发过程中,对必须使用抑菌剂的制剂应重视抑菌剂种类和用量的研究。在制剂确定处方时,应关注处方的抑菌效力是否符合现行版《中华人民共和国药典》的规定。同时,应验证成品制剂的抑菌效力在有效期内是否会因贮藏条件而降低。在制剂变更研究中,若有需要增加抑菌剂种类或用量的情况,应加强其必要性和使用安全性方面的研究。在满足制剂抑菌效力和微生物限度要求的前提下,应尽量减少用量,并低于对人体有害的浓度。对于可能引起较高安全性风险的眼用制剂、注射剂和儿童用药等,也应关注国外法规指南对合理使用抑菌剂的建议,加强制剂中抑菌剂的质量控制,在保证抑菌效力的前提下,最大限度地减小抑菌剂可能带来的安全性风险。



为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
